许瀚元 朱惠娟 潘慧 阳洪波 王林杰 龚凤英
中国医学科学院北京协和医学院北京协和医院内分泌科国家卫生健康委员会内分泌重点实验室
摘 要:
目的 构建含人脂肪酸合成酶(FAS)及激素敏感性脂肪酶(HSL)基因启动子的荧光素酶报告基因表达质粒,探究脂联素对人肝癌细胞系HepG2中FAS及HSL基因启动子活性的影响。方法 扩增人FAS及HSL启动子序列-622~+3 bp片段与-697~+53 bp片段,构建含人FAS及HSL启动子的pGL3-hFAS625-Luc(hFAS 625-Luc)与pGL3-hHSL750-Luc(hHSL 750-Luc)荧光素酶报告基因表达质粒。脂质体瞬时转染HepG2细胞,观察0.5~10.0μg/mL脂联素作用24 h或者5μg/mL脂联素作用2~32 h细胞中荧光素酶活性的变化。结果 hFAS 625-Luc与hHSL 750-Luc荧光素酶表达质粒均能在HepG2细胞中良好表达。1.0~10.0μg/mL脂联素作用24 h能剂量依赖性地促进转染hFAS 625-Luc及hHSL 750-Luc质粒的HepG2细胞中荧光素酶的表达,最高分别达到对照组的1.76倍(P<0.01)和1.37倍(P<0.01)。5μg/mL脂联素作用于转染hFAS 625-Luc质粒的HepG2细胞4 h和8 h能够促进荧光素酶的表达(P<0.01),作用16 h和32 h则抑制荧光素酶的表达(P<0.01);而脂联素对转染hHSL 750-Luc质粒HepG2细胞作用不同时间(2~32 h)均能促进荧光素酶的表达,最高为对照组的1.37倍(P<0.01)。结论 成功构建含人FAS与HSL启动子荧光素酶报告基因质粒。脂联素能够剂量依赖性地促进HepG2细胞中FAS及HSL启动子活性。脂联素作对FAS启动子的活性影响与作用时间有关,而对HSL启动子活性的影响一直表现为促进作用。
关键词:
脂联素 脂肪酸合成酶(FAS) 激素敏感性脂肪酶(HSL) HepG2细胞 启动子活性
Effects of adiponectin on the gene promoter activities of fatty acid synthase and hormone sensitive lipase in HepG2 cells
XU Han-yuan ZHU Hui-juan PAN Hui YANG Hong-bo WANG Lin-jie GONG Feng-ying
Department of Endocrinology, Key Laboratory of Endocrinology of National Health Commission, Peking Union Medical College Hospital,CAMS & PUMC;
Abstract:
Objective To investigate the effects of adiponectin on human FAS and HSL gene promoter activities in human hepatocarcinoma cell line HepG2 transfected with plasmids containing human FAS or HSL promoters fused to a luciferase reporter gene. Methods The luciferase reporter gene expression plasmids pGL3-hFAS625-Luc(hFAS625-Luc) and pGL3-hHSL750-Luc(hHSL 750-Luc) were constructed. HepG2 cells were then transfected with these plasmids by lipofectamine method. The FAS and HSL promoter activities was evaluated by testing the luciferase activity through incubation with 0.5-10.0 μg/mL adiponectin) for 24 h or 5 μg/mL adiponectin for 2-32 h. Results Both hFAS 625-Luc and hHSL 750-Luc plasmids were well expressed in HepG2 cells. 1.0-10.0 μg/mL adiponectin could progressively increase the luciferase expression in HepG2 cells transfected with hFAS 625-Luc and hHSL 750-Luc plasmids with the maximum effect of 1.76 folds(P<0.01) and 1.37 folds of the controls, respectively, at the concentration of 10.0 μg/mL(P<0.01). Moreover, 5 μg/mL adiponectin promoted the expression of luciferase in HepG2 cells transfected with hFAS 625-Luc plasmids at 4 h and 8 h(P<0.01), and inhibited the expression of luciferase at 16 h and 32 h(P<0.01). Adiponectin promoted the expression of luciferase in HepG2 cells transfected with HSL 750-Luc within different durations(2~32 h), and the highest was 1.37 times of the control group at 2 h(P<0.01). Conclusions The luciferase reporter gene plasmids containing human FAS and HSL promoters are successfully constructed. Adiponectin promotes FAS and HSL promoter activities in HepG2 cells with a dose-dependent manner. Adiponectin has a double effect on FAS promoter activity in different times, while it has a promoting effect on HSL promoter activity with different incubation durations.
Keyword:
adiponectin; fatty acid synthase(FAS); hormone sensitive lipase(HSL); HepG2 cell; promoter activity;
脂联素(adiponectin)是一种主要由脂肪细胞分泌的脂肪细胞因子,主要作用于肝脏和脂肪组织,发挥调节脂代谢、增加胰岛素敏感性、抗感染等的作用[1]。研究发现,肥胖患者的血清脂联素水平降低[2]。脂联素过表达能使高脂饮食喂养的小鼠肝脏中三酰甘油含量下降,内脏脂肪组织减少[3]。进一步研究表明,脂联素能够通过调节脂肪合成与分解相关酶表达参与脂代谢的调节[4]。
脂肪酸合成酶(fatty acid synthase,FAS)与激素敏感性脂肪酶(hormone sensitive lipase, HSL)分别是在脂肪合成与分解过程中的关键限速酶[5]。研究报道,脂联素受体激动剂能够抑制C3H10T1/2小鼠间充质干细胞中FAS的表达[6],而脂联素干预原代培养的脂肪细胞能够使细胞中HSL mRNA的表达量上升[7]。但关于脂联素对人肝细胞中FAS与HSL表达的影响目前尚无相关的文献报道。
本研究旨在通过构建含人FAS与HSL启动子的荧光素酶表达质粒,探究脂联素对人肝癌细胞系(human hepatocarcinoma cell line)HepG2细胞中FAS及HSL启动子活性的影响,为进一步揭示脂联素调节肝细胞脂代谢的作用提供实验依据。
1 材料与方法
1.1 试剂与材料
DMEM/NEAA培养基(Hyclone公司);Opti-MEM减血清培养基(Gibco公司);LipofactamineTM2000转染试剂(Invitrogen公司);微孔板发光分析仪(北京滨松光子技术有限公司,BHP9504);人血DNA提取试剂盒(Omega公司);双荧光素酶测定试剂盒、pGL3-Basic质粒、pRL-SV40质粒及pBS-T质粒(Promega公司);人肝癌细胞系HepG2(中国医学科学院基础医学研究所细胞资源中心);重组人球形脂联素(Peprotech 公司);DNA测序由上海生工生物科技公司完成。
1.2 方法
1.2.1 细胞的分组与处理
1.2.1.1 构建pGL3-hFAS625-Luc荧光素酶表达质粒:
PCR扩增FAS-(622~+3 bp)片段,上游引物序列为:5′-TATTAACCACCCGTGTGCGCATTGGGCCG-3′,下游引物序列为:5′-CTCTAGGCCGGCGCCGA CGCTATTTAAAC-3′,产物大小为625 bp,经测序证实为FAS基因启动子序列后,用T4 DNA连接酶将这一片段插入过渡载体pBS-T中,然后用SalⅠ和HindⅢ 同时双酶切这一质粒和pGL3-Basic质粒(不含启动子和增强子),分别得到带这两个双酶切位点的FAS启动子序列插入片段和pGL3-Basic载体片段,用T4 DNA连接酶将二者连接,构建成含人FAS启动子(-622~+3 bp)的pGL3-hFAS(-622~+3 bp)-Luc (hFAS625-Luc)荧光素酶表达质粒,并经测序证实序列正确。
1.2.1.2 构建pGL3-hHSL750-Luc荧光素酶表达质粒:
PCR扩增HSL(-697~+53 bp)启动子,上游引物:5′-ATCTGTGGAATGACACGGGTGAATGAC-3′,下游引物:5′-CCTCCTAGGCATCTTCCGAGCTTCC-3′;产物大小为750 bp,测序证实后采用和1.2.1.1中同样的方法,构建成含人HSL启动子(-697~+53 bp)的pGL3-hHSL(-697~+53 p)-Luc (hHSL750-Luc)荧光素酶表达质粒,并经测序证实序列正确。
1.2.1.3 瞬时转染hFAS625-Luc及hHSL750-Luc荧光素酶报告基因质粒及其活性测定:
采用脂质体瞬时转染法。将增殖状态良好的HepG2细胞以8×10个细胞/孔接种于6孔板中,汇合度为50%~60%时,换为新鲜无血清DMEM/NEAA培养液,按本实验室已发表的文献操作[8],配置含不同浓度目的质粒hFAS625-Luc或hHSL750-Luc质粒以及内参质粒pRL-SV40的A液和含LipofactamineTM2000转染试剂的B液,将A、B两液混合,室温孵育20 min后,加入上述准备好的HepG2细胞6孔板中, 37 ℃ CO2孵箱孵育5 h后,更换为DMEM/NEAA培养基。40 h后,加入1×报告基因裂解缓冲液,刮下细胞,离心5 min,取20 μL上清细胞裂解液,根据试剂盒说明书,加入100 μL LARII荧光素酶反应试剂,检测萤火虫荧光素酶发光值,再加入100 μL Stop&Glo试剂,测定海肾荧光素酶活性,计算两组数据的比值。每个标本重复检测3次,取每孔标本的平均值。将转染0 μg目的质粒的细胞的荧光素酶活性测定值为1,转染不同剂量目的质粒的细胞的荧光素酶活性与之相比得出相对荧光素酶活性。
1.2.2 脂联素对FAS和HSL启动子活性的影响
1.2.2.1 不同浓度脂联素对FAS和HSL启动子活性的影响:
培养HepG2细胞,同样采用脂质体瞬时转染法,每孔细胞瞬时转染1.0 μg hFAS625-Luc或者hHSL750-Luc和0.07 μg pRL-SV40内参照质粒,转染结束后,更换为DMEM/NEAA培养基继续培养40 h。将细胞分为实验组和对照组,对照组不做处理,实验组分别加入0.5、1.0、2.0、5.0及10.0 μg/mL的脂联素,继续培养24 h后,裂解细胞,按照1.2.1.3中描述方法检测荧光素酶活性,以不加脂联素干预的对照组荧光素酶活性为1,其他组与之相比得到相对荧光素酶活性。
1.2.2.2 脂联素作用不同时间对FAS和HSL启动子活性的影响:
培养HepG2细胞,利用脂质体瞬时转染同等剂量的hFAS625-Luc或hHSL750-Luc和pRL-SV40内参照质粒,转染结束后继续培养40 h。细胞分组及检测方法如1.2.2.1,其中实验组以5 μg/mL的脂联素干预细胞,分别在干预后的2、4、8、16、32 h裂解细胞,检测细胞裂解液中荧光素酶的活性,计算得到相对荧光素酶活性。
1.3 统计学分析
细胞实验设3孔重复,每个实验至少重复3次以上。数据以均数±标准差(x¯±s)表示,采用单因素方差分析。统计分析使用SPSS22.0软件,作图采用GraphPad Prism6.05软件。
2 结果
2.1 质粒的构建与鉴定
2.1.1 成功构建含人FAS(hFAS)启动子序列的荧光素酶表达质粒:
琼脂糖凝胶电泳鉴定,hFAS625-Luc质粒在紫外灯下可见约在5 401 bp有目的条带。重组质粒经双酶切可见载体(4 776 bp)和目的(625 bp)片段(图1A),将构建的质粒进行DNA测序,测序证实序列完全正确。
2.1.2 成功构建含人HSL(hHSL)启动子序列的荧光素酶表达质粒:
琼脂糖凝胶电泳鉴定,hHSL750-Luc质粒在紫外灯下可见约在5 446 bp有目的条带,重组质粒经双酶切可见载体(4 696 bp)和目的(750 bp)片段(图1B),将构建的质粒进行DNA测序,测序证实序列完全正确。
2.2 含hFAS和hHSL启动子序列质粒在HepG2细胞中的表达情况
2.2.1 hFAS625-Luc质粒在HepG2细胞中的表达情况:
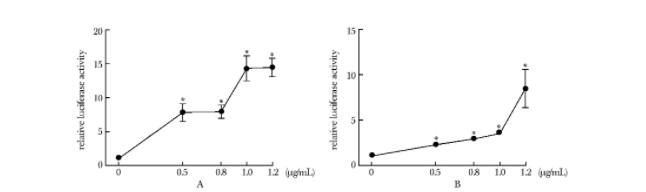
hFAS625-Luc质粒转染到HepG2细胞40 h后能良好表达,荧光素酶的绝对值在十几万~几百万之间,而且随着质粒浓度的增加,荧光素酶的表达量进一步增高,峰值达到未转染目的质粒组的14.45倍(P<0.01)(图2A)。
2.2.2 hHSL750-Luc荧光素酶表达质粒在HepG2细胞中的表达情况:
hHSL750-Luc质粒转染到HepG2细胞40 h后能良好表达,荧光素酶的绝对值在几万~二十几万之间,而且随着质粒浓度的增加,荧光素酶的表达进一步增高,峰值达到未转染目的质粒组的8.49倍(P<0.01)(图2B)。
图1 质粒的琼脂糖凝胶电泳鉴定
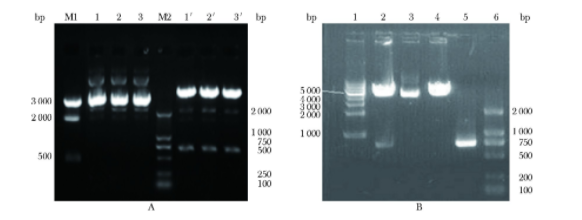
图2 不同量的质粒转染HepG2细胞后的荧光素酶表达情况
2.3 脂联素对转染hFAS625-Luc质粒的HepG2细胞中荧光素酶表达量的影响
2.3.1 不同浓度脂联素对转染hFAS625-Luc质粒的HepG2细胞中荧光素酶表达量的影响:
0.5 μg/mL的脂联素有促进HepG2细胞中荧光素酶表达的趋势,随着剂量逐渐增加,荧光素酶表达量也逐渐增加,1.0、2.0、5.0和10.0 μg/mL的脂联素干预后荧光素酶表达量分别是对照组的1.18倍(P<0.01),1.31倍(P<0.01),1.58倍和1.76倍(P<0.01)。提示脂联素能够促进转染hFAS625-Luc质粒的HepG2细胞中hFAS启动子活性,且其促进作用呈剂量依赖性(图3A)。
2.3.2 脂联素作用不同时间对转染hFAS625-Luc质粒的HepG2细胞中荧光素酶表达量的影响:
5 μg/mL的脂联素干预瞬时转染hFAS625-Luc质粒的HepG2细胞4 h及8 h后,均能促进荧光素酶的表达荧光素酶表达,分别为对照组的1.31倍(P<0.01)和1.23倍(P<0.01)。而在作用16及32 h后,脂联素对荧光素酶表达出现抑制作用,其荧光素酶表达量分别是对照组的0.87倍(P<0.01)及0.67倍(P<0.01),提示以脂联素对FAS启动子活性的影响与作用时间密切相关(图3B)。
2.4 脂联素对转染hHSL750-Luc质粒的HepG2细胞中荧光素酶表达量的影响
2.4.1 不同浓度脂联素对转染hHSL750-Luc质粒的HepG2细胞中荧光素酶表达量的影响:
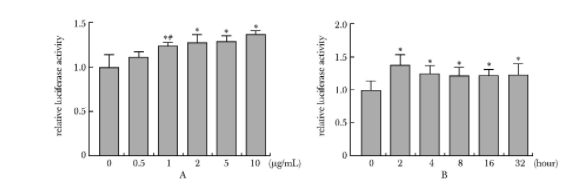
0.5 μg/mL脂联素有促进HepG2细胞中荧光素酶表达的趋势,其荧光素酶表达量是对照组的1.11倍。但随着浓度逐渐增加,荧光素酶表达量逐渐增加,1.0、2.0、5.0和10.0 μg/mL脂联素干预后,细胞的荧光素酶表达量分别达到对照组的1.24倍(P<0.01)、1.28倍(P<0.01)、1.29倍(P<0.01)和1.37倍(P<0.01),提示脂联素能够促进瞬时转染hHSL750-Luc质粒的HepG2细胞中hHSL启动子活性,且其促进作用呈剂量依赖性(图4A)。
2.4.2 脂联素作用不同时间对转染hHSL750-Luc质粒的HepG2细胞中荧光素酶表达量的影响:
5 μg/mL脂联素干预瞬时转染hHSL750-Luc质粒的HepG2细胞2 h能明显促进荧光素酶的表达,达到对照组的1.37倍(P<0.01)。随着干预时间延长,其促进荧光素酶表达的作用幅度没有继续增强,4、8、16和32 h后荧光素酶活性分别为对照组的1.24倍(P<0.01)、1.21倍(P<0.01)、1.22倍(P<0.01)和1.23倍(P<0.01), 提示以脂联素干预能促进HepG2细胞中hHSL启动子的活性,且其促进作用在2 h时达到顶峰,并在4~32 h时间区间内其促进作用没有随着时间延长而增加(图4B)。
图3 不同浓度脂联素(A)与脂联素作用不同时间(B)对转染hFAS启动子的HepG2细胞中荧光素酶活
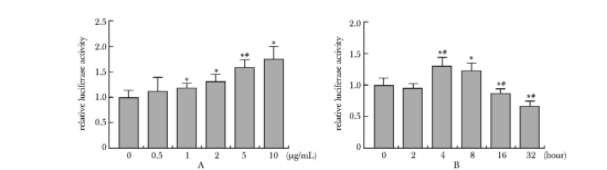
图4 不同浓度脂联素(A)与脂联素作用不同时间(B)对转染hHSL启动子的HepG2细胞中荧光素酶活性的影响
3 讨论
本研究成功构建含人FAS及HSL启动子的荧光素酶报告基因表达质粒,并转染人肝HepG2细胞,观察了脂联素对FAS与HSL启动子活性的影响。结果发现,脂联素能够剂量依赖性地促进FAS启动子的活性。与本研究结果一致,3T3-L1脂肪细胞中过表达脂联素,能使细胞胞内脂滴体积更大,脂肪合成相关转录因子如CAAT/增强子结合蛋白α(CAAT/ enhancer binding protein,C/EBPα)等表达上调[9]。同时,在脂联素基因敲除的小鼠中也发现,脂联素敲除小鼠肝脏中FAS表达水平是下降的[10]。但与上述研究结果不同的是,以25 μg/mL脂联素对FaO细胞作用8 h后,细胞中FAS的表达量显著下降[11];此外,在HepG2肝细胞中过表达脂联素受体,FAS的表达明显降低[12]。而在动物实验中,脂联素干预高脂饮食诱导肥胖小鼠2周后,肝脏FAS的表达明显下降[13]。且实验发现,与对照组相比,过表达脂联素受体的高脂饮食喂养小鼠,体质量降低,脂肪组织质量减轻,同时肝脏FAS的表达也明显下降[14]。这些实验结果的不一致可能是由于实验所用脂联素剂量不同,采用的动物模型不同以及干预的时间不同所致,具体机制仍需更多实验探索。另外,本研究还发现,脂联素作用4和8 h能促进hFAS启动子的活性,而在作用16及32 h后,则转变为抑制作用。结合前述脂联素浓度依赖性对HepG2细胞中FAS启动子活性的影响的作用时间是24 h,说明脂联素对FAS启动子活性的影响出现先升高(4和8 h),再降低(16 h),再升高(24 h),再降低(32 h)的变化趋势。与此结果相似, 在FaO肝细胞中也观察到,以脂联素干预FaO细胞2 h对FAS的表达有促进趋势,而在干预8 h后则转变为抑制作用[11]。这些结果提示,脂联素对FAS表达的影响与作用时间有关。
本研究还发现,脂联素能够剂量及时间依赖性地促进HepG2细胞中HSL启动子活性。与此结果一致,脂联素也能够促进C2C12成肌细胞中的脂肪分解[15]。 类似的,还有研究发现,与对照组相比,脂联素敲除小鼠肝脏HSL mRNA表达降低[16]。这些结果提示,脂联素能够通过促进肝细胞HSL启动子活性,促进肝细胞中脂肪分解。
综上所述,本研究成功构建hFAS625-Luc及hHSL750-Luc质粒并利用瞬时转染技术使该质粒在HepG2细胞中良好表达,发现脂联素能够剂量依赖性地促进FAS及HSL启动子活性,而脂联素对FAS启动子活性影响与作用时间相关,而对HSL启动子活性则一直表现为促进作用。这些研究结果进一步揭示了脂联素调节肝细胞脂肪合成和脂肪分解的作用,为未来将脂联素应用于改善肝脏脂代谢异常的治疗提供了实验依据。
参考文献
[1] Achari AE,Jain SK.Adiponectin,a therapeutic target for obesity,diabetes,and endothelial dysfunction[J].Int J Mol Sci,2017,18:1321-1337.
[2] Thanakun S,Pornprasertsuk-Damrongsri S,Izumi Y.Increased oral inflammation,leukocytes,and leptin,and lower adiponectin in overweight or obesity[J].Oral Dis,2017,23:956-965.
[3] Asterholm IW,Scherer PE.Enhanced metabolic flexibility associated with elevated adiponectin levels[J].Am J Pathol,2010,176:1364-1376.
[4] Simo R,Saez-Lopez C,Lecube A,et al.Adiponectin upregulates SHBG production:molecular mechanisms and potential implications[J].Endocrinology,2014,155:2820-2830.
[5] Saponaro C,Gaggini M,Carli F,et al.The subtle balance between lipolysis and lipogenesis:a critical point in metabolic homeostasis[J].Nutrients,2015,7:9453-9474.
[6] Wang SJ,Lu WY,Liu KY.Adiponectin receptor agonist AdipoRon suppresses adipogenesis in C3H10T1/2 cells through the adenosine monophosphate activated protein kinase signaling pathway[J].Mol Med Rep,2017,16:7163-7169.
[7] Wedellova Z,Kovacova Z,Tencerova M,et al.The impact of full-length,trimeric and globular adiponectin on lipolysis in subcutaneous and visceral adipocytes of obese and non-obese women[J].PLoS One,2013,8:e66783.doi:10.1371/journal.pone.0066783.
[8] Gong FY,Shi YF and Deng JY,et al.The regulatory mechanism by which interleukin-6 stimulates GH-gene expression in rat GH3 cells[J].J Endocrinol,2006,190:397-406.
[9] Yang W,Yang C,Luo J,et al.Adiponectin promotes preadipocyte differentiation via the PPAR gamma pathway[J].Mol Med Rep,2018,17:428-435.
[10] Liu Q,Yuan B,Lo KA,et al.Adiponectin regulates expression of hepatic genes critical for glucose and lipid metabolism[J].Proc Natl Acad Sci U S A,2012,109:14568-14573.
[11] Awazawa M,Ueki K,Inabe K,et al.Adiponectin suppresses hepatic SREBP1c expression in an AdipoR1/LKB1/AMPK dependent pathway[J].Biochem Biophys Res Commun,2009,382:51-56.
[12] Chou IP,Lin YY,Ding ST,et al.Adiponectin receptor 1 enhances fatty acid metabolism and cell survival in palmitate-treated hepg2 cells through the pi3 k/akt pathway[J].Eur J Nutr,2014,53:907-917.
[13] Xu A,Wang Y,Keshaw H,et al.The fat-derived hormone adiponectin alleviates alcoholic and nonalcoholic fatty liver diseases in mice[J].J Clin Invest,2003,112:91-100.
[14] Ma Y.and Liu D.Hydrodynamic delivery of adiponectin and adiponectin receptor 2 gene blocks high-fat diet-induced obesity and insulin resistance[J].Gene Ther,2013,20:846-852.
[15] Fruebis J,Tsao TS,Javorschi S,et al.Proteolytic cleavage product of 30-kDa adipocyte complement-related protein increases fatty acid oxidation in muscle and causes weight loss in mice[J].Proc Natl Acad Sci U S A,2001,98:2005-2010.
[16] de Mendonca M,Dos Santos BAC,de Sousa E,et al.Adiponectin is required for pioglitazone-induced improvements in hepatic steatosis in mice fed a high-fat diet[J].Mol Cell Endocrinol,2019,493:110480.doi:10.1016/j.mce.2019.110480.



