摘 要:
自本世纪初科学家实现高单分散纳米氧化铁的可控制备以来,基于高生物学安全性的纳米氧化铁或者掺杂纳米铁氧体磁性材料的生物医学应用研究出现了爆发式增长,成为目前纳米生物学和纳米医学领域前沿热点之一,特别是其独特的磁学性质,使得磁性纳米材料能够介导外磁场产生纳米尺度的物理效应,并作用于微纳尺度的生物靶点。通过多学科交叉研究,有望建立基于磁性纳米材料的可控、组织可穿透、安全和精准的疾病诊断和治疗新模式,提高疾病的治疗疗效并改善预后。文章综述了近年来氧化铁颗粒在生物医学应用中的一些最新进展,主要集中讨论了磁性纳米材料在新型磁共振成像对比剂、肿瘤磁热治疗和磁力生物调控等应用方向的机遇与发展。
关键词:
磁性纳米材料 磁共振成像 纳米磁力生物调控 磁感应热
Magnetic nanomaterials and their application in biomedicine
CHEN Xiao-Yong LIU Xiao-Li FAN Hai-Ming
Division of Life Science and Medicine,College of Chemistry and Materials Science,Northwest University;
Abstract:
Since the successful synthesis of highly monodispersed iron oxide nanoparticles at the beginning of this century, the biomedical application of these nanoparticles has undergone an explosive growth, becoming the frontier in nanobiology and nanomedicine. In particular, due to their unique properties, magnetic nanoparticles can mediate an external magnetic field and produce physical effects such as induction heat and mechanical force that can further act upon the biotargets on the micro/nano scale. Hence, by using an interdisciplinary approach, novel magnetic nanoparticle based therapeutic modalities that are controllable, safe and accurate are anticipated for disease diagnosis and therapy, so that the therapeutic efficacy and prognosis of diseases can be improved. In this review, the advances in biomedical application of iron oxide nanomaterials in the past five years will be surveyed, and the opportunities and development of these nanomaterials for magnetic resonance imaging, magnetic thermotherapy and biomechanical regulation will be discussed.
Keyword:
magnetic nanomaterials; magnetic resonance imaging; magnetomechanical bioregulation; magnetic induction
1 引言
近年来,随着纳米科学与技术的快速发展以及其与生命科学、医学工程学等学科的交叉融合,产生了如纳米医学、纳米生物学等许多新兴学科和领域。这些交叉领域的研究有望为解决当前重大疾病诊疗领域的技术挑战提供新思路和新方法。在诸多生物医学纳米材料中,磁性纳米生物材料因其独特的磁学性质在临床诊断和生物医学研究中获得了广泛应用,如肿瘤影像诊断和磁热疗、磁分离和即时检验、干细胞与再生医学\脑部神经刺激和可控药物递释等(图1)。
除了利用纳米材料化学组成、结构相关的生物学效应以外,磁性纳米材料生物医学应用的主要范式是:利用纳米材料小尺寸特点将其递送到特定的生物靶点,通过施加安全且无组织穿透深度限制的外磁场刺激,促使磁性纳米材料产生磁、热、力等物理效应并作用于生物靶点[1—3],继而引发多种生物学效应实现诊断或治疗功能。由此可见,磁性纳米材料是实现磁诊疗功能的介质,而其性能在很大程度上取决于纳米材料磁学特性与外部磁场之间的耦合效率以及磁场诱导物理效应对生物学效应的激活效能。该领域科学研究的最终目标是在活体内实现可远程磁操控的医疗纳米机器人,能够进行疾病预警并遵循医生指示执行相关治疗功能。为更好地实现这个远景目标,需要材料化学、纳米磁学、生物学、医学以及工程学等多个学科知识深度融合,并在不断的发展过程中逐渐形成“纳米磁医学工程”等新的交叉学科和方向。
安全并有效是医疗技术临床应用的要求,磁性氧化铁颗粒是当前唯一被批准用于临床的无机材料纳米药物,具有优异的安全性。而磁场相关医疗技术往往具有非侵入式、可实时调控、无辐射危害等优势。因此,以临床医学应用的角度,开展磁场作用下氧化铁纳米材料生物效应的跨学科、创新性的科学研究有望为生物医学领域带来变革性的医疗技术,改善当前疾病治疗效果,满足我国人民对健康和美好生活的期盼。
图1 氧化铁纳米颗粒的生物医学应用

本世纪初科学家实现了高单分散氧化铁颗粒的可控制备,之后基于纳米氧化铁或者掺杂铁氧体等材料展开的生物医学应用研究发生了爆发式的增长,是纳米生物学和纳米医学领域长期的研究热点和前沿领域之一。此外,在研究中不断发现的氧化铁颗粒新生物效应更是进一步推动了生物医学前沿领域的发展。例如,2007年氧化铁纳米颗粒类酶效应的发现,引发了“纳米酶”这个全新的研究领域,推动了生物检测和医学治疗等技术的发展[4]。氧化铁纳米颗粒介导的磁感应热效应也在组织冷冻复苏、体调控胚胎干细胞治疗糖尿病、药物可控释放等方面取得了突破性进展。近年已有大量氧化铁纳米颗粒的生物医学应用进展综述,但其在磁场介导下的生物医学前沿发展仍待总结。因此,本文综述了近年来基于纳米氧化铁在磁场介导下产生的磁、热和力效应的生物医学应用研究现状与进展,特别是其在磁共振成像、肿瘤治疗、细胞功能调控等生物医学领域的机遇与发展,进一步讨论了应对现有挑战的可能途径。
2 磁场诱导的物理效应
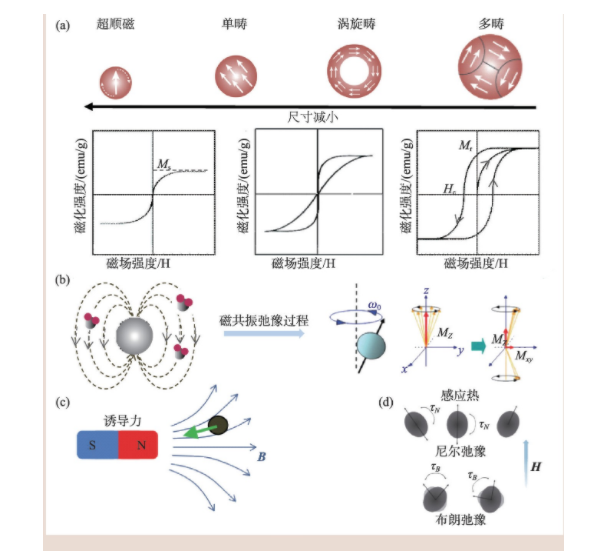
磁学性质是磁性纳米材料生物医学应用的关键,通过材料设计可以有效的调控纳米材料的磁学特性,从而提升应用性能。一般来说,其磁学性能参数主要包括:饱和磁化强度(Ms)、磁各向异性(K)、剩磁(Mr)和矫顽力(Hc)等。磁化强度是描述宏观磁介质磁性强弱程度的物理量。对于铁磁有序的纳米氧化铁材料,其随外磁场不断增强能够达到的最大磁化强度即饱和磁化强度,该参数与纳米材料的尺寸、组分和形貌等相关。例如,饱和磁化强度在阈值内随颗粒尺寸的增加成比例地增大,超过阈值后趋于恒定并且接近体相材料的磁化强度[5]。磁各向异性是指在不同方向磁化难易程度不同,包括磁晶各向异性、表面各向异性及交换各向异性。磁晶各向异性受晶胞结构影响,如氧化铁纳米颗粒中Fe2+完全被Co2+替代时,磁各向异性比原来颗粒增加了20倍[6]。表面各向异性及交换各向异性受颗粒形貌影响,一般比表面积大的纳米颗粒对表面各向异性贡献更显著,核壳结构也会影响交换各向异性[5,7]。矫顽力能体现材料抵抗退磁的能力,受颗粒尺寸变化的影响较为显著。纳米材料晶粒尺寸小于单畴尺寸时,其矫顽力随粒径的增大而增大。由此可见,铁磁性纳米材料表现出尺寸依赖的磁学特性,当尺寸小于某一临界值,其磁晶各向异性能(KV)小于室温热能(KT)时,其矫顽力与剩磁趋向于零,呈现超顺磁性质。
磁性纳米材料响应外磁场可以产生多种物理学效应,不同的应用对材料磁学性能的要求不同。因此,设计高应用性能磁性纳米介质时,需要综合多方面因素考虑(图2)。磁性纳米材料在外磁场作用下,可产生局域的诱导磁场。该局域磁场能够影响被射频脉冲激发的氢质子弛豫过程,显著缩短弛豫时间,从而增强该区域的磁共振信号。纳米氧化铁作为典型的T2磁共振增强对比剂,其弛豫效能与饱和磁化强度的平方成正比。在梯度磁场或者旋转磁场下,磁化的纳米材料可以产生纳米尺度的力学效应,其磁力大小与饱和磁化强度与外磁场梯度的积成正比。在外加中频交变磁场(100—500 kHz)中,磁性纳米材料可通过磁滞损耗将磁场的能量转化为热能[8]。对于超顺磁纳米颗粒,其产热机制可以简化为布朗和尼尔弛豫损耗之和。当颗粒尺寸大于单畴尺寸时,其布朗弛豫对产热有较大的贡献;而小于单畴尺寸的颗粒主要以尼尔弛豫贡献为主,与磁各向异性能成正比[9]。磁性纳米材料磁热效率可以用比吸热速率(SAR)或固有损耗功率(ILP)来评价,产热效率与磁场的频率和强度以及颗粒的饱和磁化强度有关。比吸收速率没有考虑磁场参数的影响,不能将不同磁场参数下的实验结果进行比较,而固有损耗功率与磁场参数无关,可以用来衡量不同外场下材料的磁热转换性能。
图2 纳米氧化铁尺寸依赖的磁学特性与医学应用基础
3 磁共振成像对比剂
目前磁共振成像在临床影像诊断和疾病监测中广泛应用。对比剂可增强病灶部位的信号,提高其与周围正常组织的对比度,从而提高影像灵敏度和早期检测能力[13,14]。对比剂通常是通过可缩短氢质子的纵向弛豫时间(T1对比剂)或横向弛豫时间(T2对比剂)来增强正常组织和病变组织之间的对比度。T1对比剂可以使目标区域变得更亮,是阳性对比剂,T2对比剂使得病变组织成像变暗,属于阴性对比剂。T1和T2对比剂的弛豫增强效能分别用弛豫率r1和r2来衡量,一般来说,要获得较大的r2值,要求纳米颗粒具备较高的磁化强度。例如:Fe3O4纳米环因其较高的磁化强度以及高磁场不均匀度,因此具有大的磁共振r2*值,较传统超顺磁氧化铁增强4倍[15]。然而,T2成像易与出血、钙化、金属沉积等低信号区域混淆,从而导致临床检测过程中漏诊、误诊病灶。因此,发展基于纳米氧化铁的新型T1对比剂有望改善磁共振影像诊断性能,也是当前的研究热点之一。
3.1 氧化铁T1对比剂
顺磁性离子是磁共振T1信号增强的关键,游离的Fe2+和Fe3+顺磁性离子都能够导致T1信号增强。对于纳米氧化铁来说,随着其尺寸急剧减小,其表面顺磁性铁离子占比显著提高,小尺寸还同时抑制了颗粒内核的磁化强度和T2弛豫效能;当尺寸减小到5 nm以下,这种由高占比的表面顺磁性非晶层与内部极小铁磁性晶核构成的核壳结构纳米氧化铁整体表现为准顺磁特性,具有高r1弛豫率和低的r2/r1比值,可作为新型、低毒的T1对比剂。2002年,Taupitz等评估了柠檬酸修饰的4 nm氧化铁VSOP-C91作为T1对比剂用于磁共振血管造影,结果显示超小尺寸的氧化铁可展现较好的血管T1信号增强[16]。即便如此,高单分散的超小氧化铁的制备在当时仍是一个挑战。2011年,韩国首尔大学Hyeon课题组利用油酸铁作为前驱体,油醇作为还原剂,在苄醚溶液中大规模制备了单分散超小氧化铁纳米颗粒(1.5 nm,2.2 nm,3 nm),并以3 nm作为模型系统评估了其活体血管成像效果[17]。随后该课题组还利用小猎犬和恒河猴等大动物模型评估了该对比剂的安全性以及脑缺血疾病的诊断效果。这些结果表明超小氧化铁纳米颗粒有望成为下一代高效、安全的磁共振对比剂[18]。然而超小纳米氧化铁对比剂的T1弛豫率仅为4.6 s-1·m M-1,与临床钆基对比剂弛豫效能相比并无优势。此外,由于小尺寸可控制备难,纳米对比剂弛豫增强理论发展滞后,超小铁氧体的磁学结构以及T1信号增强机制尚不清楚,因此,很难对其性能优化。
2017年,我们课题组利用金属羧酸配合物的热分解性质,提出了一种普适的动同步热分解法,成功制备了一系列高单分散超小(小于4 nm)铁氧体纳米颗粒。其次,通过分析组分、晶体结构与磁学特性的关系,明确了其铁磁晶核与顺磁非晶壳层构成的“准顺磁”自旋有序磁结构。再者,系统研究了准顺磁结构中不同铁磁晶核与顺磁壳层对T1弛豫增强的影响,揭示了其T1弛豫增强并非由普遍认为的单一内球弛豫机制主导,而是由壳层主导的内球弛豫和晶核主导的外球弛豫协同增强。按照该理论优化的准顺磁纳米锰铁氧体(UMFNP),其T1弛豫率高达8.43 s-1·mM-1,较临床钆基对比剂提升2倍,活体影像实验证明了准顺磁锰铁氧体高清晰的T1血管成像性能(图3)[19]。2019年,进一步系统地评估了超小锰铁氧体纳米颗粒中锰含量与体内肝部T1对比增强性能的关系,揭示了其跨膜金属转运蛋白SLC39A14介导的肝特异性磁共振成像机制。研究表明:随着超小锰铁氧体中锰含量的增加,r1先增大(MnxFe3-xO4,x=0.75),然后又逐渐降低(x=1.57)。然而,随着锰含量的增加锰铁氧体颗粒在肝脏的富集程度也随之增加,过高的锰含量也会导致细胞存活率降低并且在一定程度上影响肝脏的排泄和分泌等功能[20]。
3.2 氧化铁T1/T2双模态对比剂
传统的氧化铁纳米颗粒磁共振造影剂通常作为单模态对比剂,而单一T1或T2模式成像由于源自脂肪、钙化、出血、血凝块和空气等内源性因素易产生假阳性信号,难以准确呈现病变组织的目标区域。发展T1/T2双模态探针,利用双模态磁共振成像,能够很好地增强其影像诊断的准确度和灵敏度。目前基于氧化铁的T1/T2双模态氧化铁纳米探针的构建主要有两种方法:一是将顺磁元素掺杂到纳米氧化铁颗粒中,例如,在氧化铁纳米颗粒中掺铕可以合成T1/T2对比剂,其T1和T2弛豫效能分别明显优于Fe3O4或Eu2O3纳米颗粒[21];二是通过优化氧化铁纳米颗粒的尺寸以及表面,或形成核壳结构来实现两种模式成像的兼容。这些方法构建的探针都可以通过简单地使用T1或T2序列获得双模态对比增强成像,实现了诊断准确性的自确认交叉验证[17]。
不同于上述两种方法,准顺磁超小纳米氧化铁为磁共振成像提供了一种T1/T2增强动态变换的成像新模式。由于超小纳米氧化铁独特的准顺磁特性,分散良好的超小纳米氧化铁表现为T1对比增强。然而,团聚的超小纳米氧化铁由于颗粒之间的磁偶极相互作用,则表现为超顺磁性和T2对比增强。基于这个原理,利用肿瘤组织的弱酸性pH、酶、氧化还原等内源性刺激,促使准顺磁纳米探针从团聚到分散或者相反过程的变化,即可实现T2向T1或T1向T2增强动态可变的磁共振成像。Ling等合成了对pH敏感的磁性氧化铁团聚体纳米探针,该探针通过pH诱导从聚集体到分散状态纳米颗粒的变化,实现了T2向T1对比效果的转变[22]。Wang等利用亚5 nm超小氧化铁纳米颗粒在肿瘤酸性微环境中自组装行为,实现了T1加权对比转换为T2加权对比效果[23]。Jia等合成了整合素(RGDyK)修饰的超小Fe3O4纳米探针[24,25],适合的水动力学尺寸,使其能够在肿瘤间质内逐渐积聚,从而使得磁共振信号从T1加权对比效应(弥散性纳米颗粒)向T2加权对比效应(聚集性纳米颗粒)转变,并呈现出对于时间的依赖性。
3.3 基于氧化铁的多模式影像探针
磁共振成像在应用中存在如准确定量困难以及灵敏度相对较低等局限性,通过设计多模式纳米探针可实现与其他成像方式的集成和优势互补,从而提高诊断的灵敏度、准确性和定量能力。例如,Li等通过水热法一步制备了Fe3O4/Au纳米颗粒,并将其用于磁共振—电子计算机断层扫描(MRI-CT)双模态成像[26]。该纳米颗粒具有高T2弛豫效能,良好的X射线衰减特性以及较高的Fe3O4/Au摩尔比,显著提高了成像的准确度。Cho等在锰铁氧体纳米颗粒上修饰了血清白蛋白的酪氨酸残基,用于磁共振—正电子发射断层成像(MRI-PET)[27]。所得的双显影剂在MRI和PET图像中均获得高度敏感的信号,进一步将两者的图像融合分析,可以准确地检测出毫米级不同类型的微小前哨淋巴结。Sun等通过水/油/水(W/O/W)双乳液法将氧化铁纳米颗粒包裹在聚乳酸-羟基乙酸共聚物(PLGA)微胶囊中,实现了胆碱间变性鳞状兔肝癌细胞(VX2)的体内磁共振成像和超声成像信号的同时增强[28]。Du等成功地开发出了一种磁性铁氧体纳米颗粒(MFNPs),并首次实现了纳米颗粒在体双模式磁共振—磁粒子(MRI-MPI)图像指导的高效磁热疗,为恶性肿瘤的磁诊疗一体化提供了新的策略[29]。目前,通过设计基于氧化铁的多功能纳米探针,将不同影像技术如单光子发射计算机断层扫描(SPECT)、荧光成像(FLI)、光声成像(PAI)等与磁共振成像结合所形成的多模式精准成像越来越受到研究者们关注[30]。
图3 体内准顺磁锰铁氧体(UMFNP)增强的磁共振图像[19]
4 基于磁力的生物医学应用
磁性纳米颗粒在梯度磁场或者旋转磁场能产生力学效应,该“纳米磁力”可用于调控细胞功能和命运,如破坏细胞膜系统或细胞骨架,从而导致细胞凋亡或坏死。Shen等报道了磁性纳米粒子和表皮生长因子(EGF)在低频场作用下可自组装形成磁力刀(MNPS-EDF)导致溶酶体膜和细胞膜的破裂,使得90%以上的细胞死亡(图4)[31]。Master等发现施加外场可使被内吞至溶酶体的纳米颗粒(7—8 nm)旋转,导致微丝损伤,从而破坏细胞结构[32]。纳米磁力还可以用来促进干细胞分化和功能组织的形成,例如Kang等通过施加不同频率外场控制氧化铁纳米颗粒与精氨酰-甘氨酰-天冬氨酸(RGD)复合物(SPIO-RGD)振荡速率,在体内/外实现了对巨噬细胞的粘附和极化表型的远程操纵[33]。Hu等证明磁机械力刺激对人骨髓源性间充质干细胞(hMSCs)的成骨分化有显著的影响[34]。
巧妙设计的微纳磁体结构也可以实现对具有高生物相容性的磁驱动纳米机器人的开发。Hu等开发了一种主体由有机硅外壳和钕铁硼材料构成的磁软体机器人。这类软体机器人可以通过随时间变化的外磁场控制改变自身形态,实现在液体内部和表面的游动和攀爬,或在固体表面滚动、行走和越过障碍物等行为[35]。Cui等通过对柔性氮化硅(Si3N4)薄片基板上的单畴纳米钴磁体阵列进行磁编程,将多个变形指令编码到微机器中(图5(a),(b))。当被编程的纳米磁铁暴露于外加磁场中时,磁力会驱动组件移动。通过构建一种微米级的“人工鸟”,实现了在磁场驱动下的震翅、悬停、转身和滑翔等飞行动作(图5(c),(d))[36]。可磁操纵的纳米机器人理论上还能够在微小血管中实现定向药物输运、生物活检及心脏支架安置等,其进一步的发展有望在微创医学领域带来颠覆性的突破。
图4 低频磁场下溶酶体膜和细胞膜破坏机制[31]
5 基于磁感应热的生物医学应用
5.1 肿瘤磁热疗
磁热疗(MTT)是一种新型的抗肿瘤物理治疗方法。它利用磁性纳米颗粒在交变磁场作用下产热效应以及肿瘤细胞比正常细胞热耐受性差的特性,将磁性纳米颗粒注入到肿瘤部位,然后施加交变磁场,选择性杀死肿瘤细胞。自1957年肿瘤磁热疗概念提出,至今已发展了60多年,特别是近10年受益于纳米材料技术的快速发展,该治疗的疗效显著提高,目前该治疗手段已获得欧盟认证用于临床治疗,并在美国完成了前列腺癌治疗的临床注册,是当前纳米医学和转化医学的研究热点。目前生物医用磁性纳米颗粒通常为尺寸小于20 nm的超顺磁氧化铁纳米颗粒,然其小尺寸和弱的磁学性质导致磁热转换效率(SAR约为250 W/g)低,严重制约肿瘤磁热治疗疗效。调控纳米氧化铁的粒径[37]、组分[38]、形貌[5,39]和表面修饰[40]等是目前提高磁热转化效率的主要手段。例如,Lee等人通过形成软磁和硬磁的核壳结构调控K值,使纳米颗粒的比功率损失(SLP)值得到了大幅提高。CoFe2O4@MnFe2O4的比功率损失高达2280 W/g,其值远远高于9 nm的硬磁性材料CoFe2O4(443 W/g)和15 nm(411 W/g)的软磁性材料[9]。Noh等发现,18 nm立方体纳米颗粒Zn0.4Fe2.6O4由于其表面自旋无序层占比(4%)小于球形纳米颗粒(8%),导致立方体较球形磁热转化效率更高[5]。我们课题组近年来发展了一种新型涡旋磁畴结构的氧化铁纳米环,由于其小尺寸边界效应和特殊的结构,其磁矩在面内沿顺时针或逆时针方向呈涡旋状分布,形成磁化闭合分布的独特多畴结构。它同时拥有超顺磁氧化铁纳米颗粒的溶胶分散性又具备外场诱导的涡旋—洋葱态磁化反转导致大磁滞损耗和接近体相材料的优良磁学性能。在交变磁场作用下,其磁热转换效率较超顺磁纳米颗粒提高了一个数量级,以荷瘤小鼠为模型,磁热治疗时间从临床60 min缩短到10 min,剂量从5—10 mg Fe/kg肿瘤组织减少到0.5 mg Fe/kg肿瘤组织,证明高磁热转换效率的材料可显著改善肿瘤磁热疗技术、降低剂量和毒副作用[41]。
以往研究认为,磁热疗杀死肿瘤细胞主要依赖于热效应,即肿瘤部位的宏观温度必须达到43℃以上才能有杀死肿瘤细胞的作用,因此宏观热效应成为预测肿瘤抑制效率和磁热疗疗效的关键指标。近期研究表明:纳米颗粒在细胞内的微观热效应可能是决定其疗效的主要原因。由纳米氧化铁介导的微观、纳米尺度热效应不仅可以调节蛋白酶活性,还可以在肿瘤乏氧微环境中显著增强活性氧(ROS),从而实现对实体肿瘤及其转移瘤的高效抑制。深入理解纳米氧化铁介导的磁热过程中产生活性氧的生物学效应,对实现精准磁治疗具有重要的意义。例如,已有报道肿瘤微环境中活性氧的升高可促进免疫应答攻击肿瘤细胞,但在传统的磁热疗中,这个效应被完全忽略了。我们最近将纳米氧化铁的磁感应热效应和其诱导活性氧相关的免疫效应相结合,提出了一种新型的磁热动力疗法(MTD),该疗法突破传统磁热疗的局限性,有效抑制肿瘤生长[42]。首先,通过纳米氧化石墨烯片(GO)偶联的涡旋磁氧化铁(FVIOs),形成FVIOs-GO纳米复合物。该纳米材料在交变磁场刺激下,能够增强磁热转化效率,促进活性氧产生。体外和体内实验结果均表明,在乏氧肿瘤微环境和生理可耐受温度(~40℃)的条件下,磁热增强的活性氧引发了显著的免疫响应(图6);该复合物的磁热动力学疗法可导致83%的4T1乳腺癌细胞表面暴露钙网蛋白,直接促进巨噬细胞极化到促炎M1表型,并增加肿瘤浸润T淋巴细胞。进一步,4T1皮下乳腺肿瘤模型的静脉给药抗肿瘤实验结果说明,在热效应和活性氧相关免疫效应的双重作用下,该疗法以低剂量(3 mg/kg)和较少的交变磁场暴露时间(2次,单次10 min)即可有效抑制肿瘤生长,而传统的磁热疗需要在6—18 mg/kg的剂量下进行4—8次交变磁场处理才可达到类似疗效。磁热动力学疗法的提出不仅促进了传统肿瘤磁热疗的发展,克服了其仅依赖于热效应的不足,而且深化了对纳米氧化铁介导的肿瘤磁热疗机制的理解;通过联合活性氧介导的免疫效应,不仅显著提高抗肿瘤疗效,还为将来精准、高效的纳米磁治疗提供了新的思路。
5.2 磁热联合治疗
磁热疗不仅能够通过诱导产热杀死肿瘤细胞,还可作为临床肿瘤放、化疗的辅助疗法,以及协同增效肿瘤光热/光动力治疗、免疫治疗等[43,44]。磁性颗粒负载药物分子不仅可以改善化疗药物的毒副作用,还可在交变磁场下实现药物的磁热可控释放并提高化疗疗效。例如,Ren等开发了一种将化疗药物道诺霉素(DNR)、P-糖蛋白抑制剂5-溴粉防己碱(5-BrTet)与磁性纳米颗粒复合的纳米药物(Fe3O4-MNPs-DNR-5-BrTet),有效抑制裸鼠白血病异种肿瘤生长,并且导致P-糖蛋白的表达量明显下调[45]。磁感应热在放疗增敏过程中也可发挥重要的作用,物理热效应可通过干扰受损伤肿瘤DNA的修复,增强放疗对肿瘤细胞和血管的损伤。Espinosa等通过设计一种具有高热转换效率的钆掺杂氧化铁纳米颗粒,发现热疗通过降低乏氧细胞(具有放疗抗性)的比例和诱导肿瘤特异性局部血管破裂及坏死,能够实现放疗增效[46]。另外,磁热疗与光热疗的结合可提供累积的热效应,实现1+1>2的协同抗肿瘤效应,例如,Ma等制备了Fe3O4-Pd纳米颗粒,在中频磁场和近红外光辐照下,可同时实现“磁热+光热”协同增强效应,并增强了活性氧产生。4T1原位乳腺肿瘤模型实验结果表明,基于该纳米颗粒的增强热转化效率和ROS可有效抑制肿瘤生长[47]。磁热疗还可与免疫检查点治疗有效协同,通过激活抗肿瘤免疫应答,增强远处肿瘤的CD8+细胞毒性T淋巴细胞的浸润,使得4T1三阴乳腺癌细胞对PD-L1检查点阻断治疗敏化,增加免疫疗法获益人群;该联合治疗也可同时改变肿瘤免疫抑制微环境,如显著下调髓源性抑制细胞(MDSCs),抑制肿瘤转移并改善预后[43]。临床实践已表明,综合治疗对肿瘤最具疗效。磁热疗与多种肿瘤治疗方法联合并增强其疗效,具有较好的临床转化价值,进一步深入研究不同疗法之间的协同机制,可为将来临床肿瘤完全治愈奠定基础。
5.3 其他生物医学应用
纳米材料介导的磁感应热不仅可以进行肿瘤治疗,还被应用于热刺激的药物释放、脑部神经调控和生物组织冷冻复苏等方面。例如,Hu等报道了一种核/壳结构纳米载体,载药二氧化硅核被单晶氧化铁壳包裹,氧化铁外壳可以防止药物扩散泄漏,当该纳米载体受到高频交变磁场作用时,薄氧化铁壳的边缘区域出现纳米尺度裂纹,进而实现磁热驱动的药物分子可控释放[48]。Chen等利用氧化铁纳米颗粒在交变磁场中的磁热效应,激活神经元的热敏辣椒素受体TRPV1,诱发神经元的钙离子内流,进而实现对小鼠腹侧被盖脑区和投射脑区神经元亚群兴奋性的远程、无线磁热可控调节[49]。此外,研究还发现磁热效应在生物组织冷冻复苏中,可以满足组织或器官解冻时快速升温、均匀加热的要求。例如,Manuchehrabadi等将二氧化硅包覆的氧化铁纳米颗粒分散于生物组织冷冻液中,施加交变磁场,能够实现冷冻液快速升温(速率约为100—200℃/min)和生物组织均匀、安全的加热解冻复苏[50]。
6 总结与展望
早在东汉时期的《神农本草经》中磁性氧化铁就被作为药物记载,而利用磁场进行诊断和治疗的磁医学在中国也有着悠久的历史。因此,基于纳米氧化铁介导磁场产生的物理效应发展出来的医疗新技术,既有传统医学的历史传承,又是现代多学科交叉融合发展的新起点。由于篇幅和时间限制,文章仅简要论述了这个领域近期的一些进展,虽未能给出全貌,但应可勾勒出其基本发展轮廓。已有的研究很清晰地表明基于磁性纳米材料的生物医学应用具有巨大的潜力,但若要进行临床转化仍有诸多问题亟待解决:(1)从基础研究出发,通过纳米磁学工程,设计安全、高性能纳米磁性材料,进一步提高其应用性能;(2)针对基础研究和临床转化,开发简便、可控磁场发生设备和控制系统;(3)明确纳米氧化铁介导磁场的物理效应与生物靶点的作用机制等。最后,加强多学科融合型人才的培养,建立交叉学科研究资助体系和评价体系,从而有力地促进相关领域发展,推动基础研究与应用研究的衔接,这也是未来科学发展的必经之路。
参考文献
[1] Jordan A et al. J. Magn. Magn. Mater.,1999,194:185
[2] Kalambur V S et al. Nanotechnology,2005,16:1221
[3]唐倩倩等.生物化学与生物物理进展,2019,46:353
[4] Gao L Z et al. Nat. Nanotechnol.,2007,2:577
[5] Noh S H et al. Nano Lett.,2012,12:3716
[6] Liu X et al. Nano Lett.,2019,19:4118
[7] Park J I et al. Chem. Comm.,2007,47:5001
[8] Noh S H et al. Nano Today,2017,13:61
[9] Lee J H et al. Nat. Nanotechnol.,2011,6:418
[10] Na H B. Advanced Materials,2009,2:2133
[11]高飞等.生命的化学,2019,39:903
[12] Shen Y J et al. Ann. Biomed. Eng.,2017,45:2475
[13] Zeng L et al. Phys. Chem. Chem. Phys.,2012,14:2631
[14] Macher T et al. Adv. Funct. Mater,2015,25:490
[15] Fan H M et al. J. Am. Chem. Soc.,2010,132:14803
[16] Taupitz M et al. Radiology,2002,222:120
[17] Kim B H et al. J. Am. Chem. Soc.,2011,133:12624
[18] Lu Y et al. Nat. Biomed. Eng.,2017,1:637
[19] Zhang H et al. ACS Nano,2017,11:3614
[20] Miao Y Q et al. Theranostics,2019,9:1764
[21] Yang L et al. Nanoscale,2015,7:6843
[22] Ling D S et al. J. Am. Chem. Soc.,2014,136:5647
[23] Wang L et al. ACS Nano,2017,11:4582
[24] Jia Z et al. Theranostics,2016,6:1780
[25] Bai C et al. Adv. Funct. Mater,2018,28:1802281
[26] Li J et al. ACS Appl. Mater. Interfaces,2013,5:10357
[27] Choi J S et al. Angew. Chem. Int. Ed.,2008,47:6259
[28] Sun Y et al. Biomaterials,2012,33:5854
[29] Du Y et al. Nano letters,2019,19:3618
[30] Jiang X et al. ACS Nano,2017,11:5633
[31] Shen Y et al. Theranostics,2017,7:1735
[32] Master A M et al. Sci.Rep.,2016,6:335605g4
[33] Kang H et al. NanoLett.,2017,17:6415
[34] Hu B et al. Int. J. Mol. Sci.,2013,14:19276
[35] Hu W et al. Nature,2018,554:81
[36] Cui J et al. Nature,2019,575:164
[37] Lv Y et al. RSC Adv.,2015,5:76764
[38] Liu X et al. NanoLett.,2019,19:4118
[39] Espinosa A et al. Adv. Funct. Mater.,2018,28:1803660
[40] Liu X L et al. J. Mater Chem.,2012,22:8235
[41] Liu X L et al. Adv. Mater,2015,27:1939
[42] Liu X L et al. ACS Nano,2020,14:1936
[43] Liu X L et al. ACS Nano,2019,13:8811
[44] Liu X L et al. Theranostics,2020,10:3793
[45] Ren Y et al. Int. J. Nanomedicine,2012,7:2261
[46] Espinosa A et al. Nanoscale,2015,7:18872
[47] Ma X W et al. Nanoscale Horizons,2019,4:1450
[48] Hu S H et al. Langmuir,2008,24:239
[49] Chen R et al. Science,2014,347:1477
[50] Manuchehrabadi N et al. Sci. Transl. Med.,2017,9:eaah4586

