摘 要:
作为临床上所使用的主要抗菌药物,抗生素为人类的一些感染疾病提供了简单有效的治疗方法。然而抗生素的过度使用以及滥用逐渐造成了超级耐药菌的出现,使得细菌感染越来越难以治疗,对人类健康造成了严重的威胁。目前由耐药菌引起的细菌感染已是全球公共卫生面临的严峻挑战,因此,发展新型具有抗菌作用且不易产生耐药性的材料/药物势在必行。在过去的十几年中,纳米技术的迅猛发展为抗菌治疗提供了很有前景的选择。通过对纳米材料与细菌相互作用机理的研究,发现了其与传统抗生素相比不易诱导细菌耐药的特点。按照材质来源的不同,纳米抗菌材料主要分为天然系、有机系及无机系。天然系包括植物来源和动物来源,受安全和生产等因素制约,无法实现大规模生产;有机系由于其稳定性差以及抗菌效果弱,在使用上受到很大的限制;无机系目前市场上主要以银系抗菌剂为主导,除易被氧化和团聚之外,其生物安全性还尚有争议。在此背景下,碳纳米材料因其生产原料广泛、特殊的结构特征和理化性质,相对良好的生物相容性而备受关注。本文介绍的碳纳米材料主要包括碳纳米管、石墨烯材料、碳点及其衍生物,是目前应用非常广泛的一类纳米材料。现有的研究结果表明,碳纳米材料具有较高的抗菌活性和不易产生耐药性的特点,在抗菌领域中已逐渐得到应用。本文就目前碳纳米材料的特性及抗菌机制的研究进行综述,介绍了碳纳米材料在医用抗菌领域中的应用现状,并对其在医用导尿管中的应用前景进行了展望,以期为解决导尿管相关性尿路感染提供依据。
关键词:
耐药菌 碳纳米材料 抗菌 医学应用
0 引言
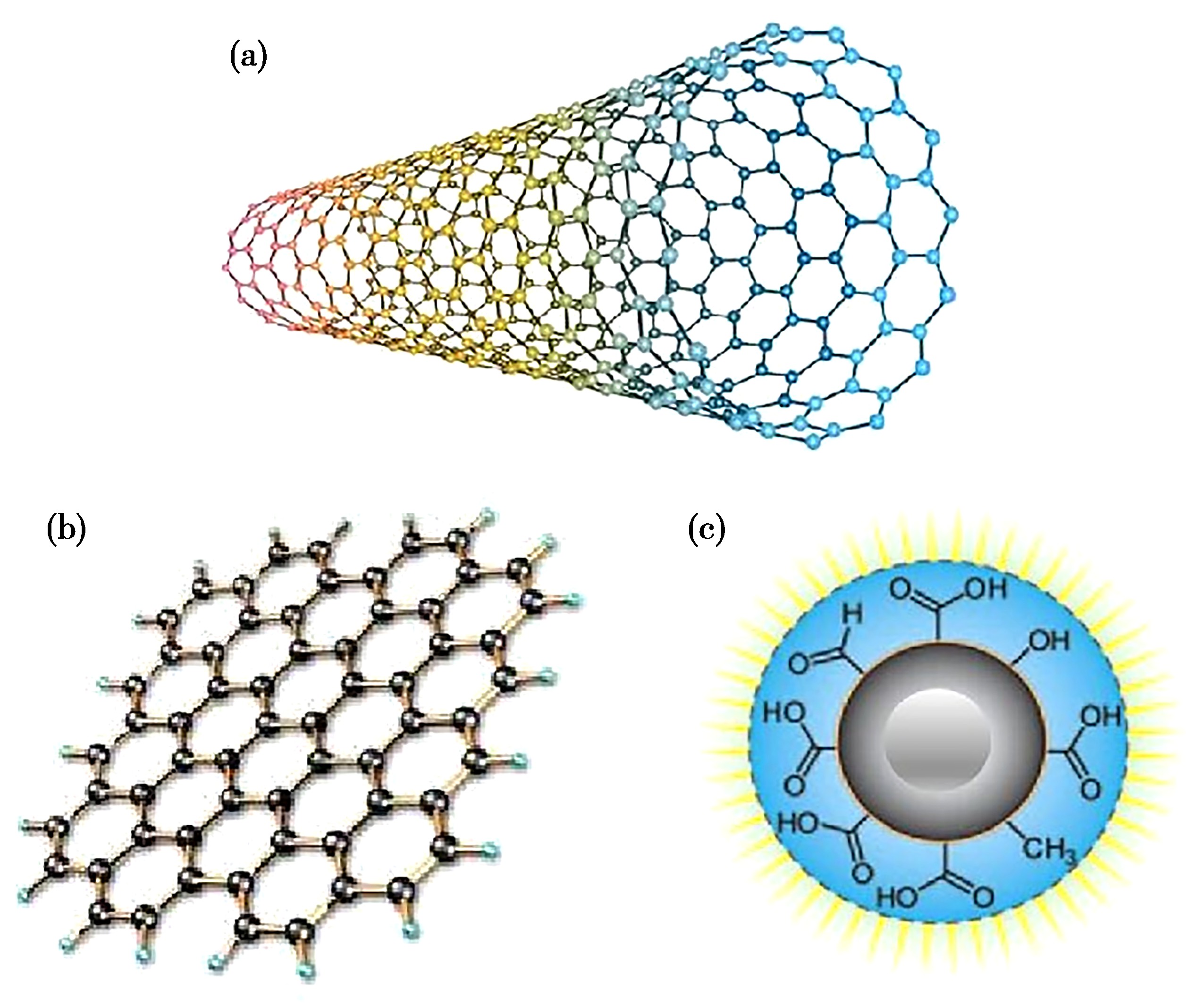
碳元素是自然界中最重要的元素之一,其原子间除了以sp3杂化形成单键,还能以sp2及sp杂化形成稳定的双键和三键,因此可以形成结构和性质迥然不同的同素异形体[1],如一维碳纳米管(Carbon nanotubes,CNTs)、二维石墨烯(Graphene)以及近年来兴起的零维碳点(Carbon dots,CDs)(图1)。在过去的十几年中,随着对碳纳米材料的大力发掘,发现了基于其本身特性(如较大的比表面和较小的颗粒数)而展现出独特的抗菌性能,能够对微生物产生抑制或杀伤作用,并且不易出现细菌耐药的问题,拓宽了纳米抗菌材料的研究范围,为以碳纳米材料为基础构建有效抗菌剂提供了新的思路和手段。除此之外,碳纳米材料制备方法简单,廉价易获取,已被认为在抗菌领域具有广阔的应用前景。
1 碳纳米材料及其复合材料的抗菌研究
1.1 碳纳米管抗菌性
CNTs是日本电气股份有限公司的科学家Iijima[2]于1991年发现的一维碳纳米材料,它是由碳原子sp2杂化形成的石墨片绕中心轴按一定的螺旋角卷曲而成的无缝、中空的管体纳米材料。CNTs比表面积大,质量轻,化学稳定性好,鉴于其特殊的形状及特有的物理抗菌作用,目前,CNTs抗菌活性应用于生物医学领域已经获得了重大成就。2007年,耶鲁大学Elimelech教授实验室的Kang等[3]从CNTs的毒性作用中得到启发,检测了CNTs与细菌的相互作用,结果发现其表现出优良的抗菌性能。从此,人们对CNTs抗菌性能的探索拉开了序幕。此外,还有研究发现,功能化后的CNTs对其抗菌活性有着显著影响,经羟基(-OH)和羧基(-COOH)修饰的CNTs能显示出较强的抗菌活性[4]。随着CNTs的研究深入,其生物相容性也备受人们关注。孟洁等[5]制备出CNTs/聚氨酯复合材料,并对该材料通过局部植入方法进行生物相容性评价。结果表明,该复合材料无明显细胞毒性,并表现出比聚氨酯材料更好的抗溶血性能、抑制血小板黏附性能以及组织相容性,该发现有望在医用人工管道中得到广泛应用。
1.2 石墨烯材料抗菌性
与CNTs相比,石墨烯材料(Graphene materials,GMs)具有相对低廉的成本和更低的生物毒性,近年来在抗菌材料领域受到了更多的关注[6-8]。石墨烯是由单层碳原子以sp2杂化形成的具有六角形晶体结构的二维碳纳米材料,于2004年由英国曼切斯特大学科学家Novoselov等[9]通过机械剥离方法制备而得。随着纳米医学研究的不断深入,以GMs为代表的新型抗菌材料近年来炙手可热。GMs主要包括石墨烯、氧化石墨烯(Graphene oxide,GO)和还原氧化石墨烯(Reduced graphene oxide,rGO)。2010年中国科学院上海应用物理所黄庆林课题组首次报道了GO的抗菌活性[10],GMs被人们认为具有构建新一代抗菌剂的潜力。Akhavan等[11]研究了GO和rGO对大肠杆菌及金黄色葡萄球菌的抗菌活性,发现GO和rGO对以上两种菌都有着明显的抗生长性,并且这两种材料对金黄色葡萄球菌的抗菌能力要大于大肠杆菌。Liu等[12]比较了石墨、氧化石墨、GO和rGO这四种石墨烯衍生物对大肠杆菌的抗菌活性,结果表明,当这四种材料的质量浓度均为40 μg/mL时,GO表现出最高的抗菌活性,接下来依次是rGO、石墨及氧化石墨。除此以外,应用于抗菌方面的石墨烯基复合材料也逐渐引起了人们的关注,目前应用最多的是石墨烯-Ag复合材料。Yang等[13]采用水热法以GO和AgNO3为原料制备了石墨烯-Ag复合物,纳米银被固定在石墨烯片层结构上,该复合物在对纳米银起稳定和保护作用的同时,也降低了纳米银的释放速度。因此,相对于纳米银,复合材料能够实现抗菌效果的持久性[14]。Tang等[15]研究发现纳米银-GO复合材料对哺乳动物具有较低的细胞毒性。因此,以GMs为基础构建有效抗菌剂为抗菌领域的发展提供了新思路。
1.3 碳点抗菌性
CDs是2004年Xu等[16]在制备CNTs时偶然发现一种粒径小于10 nm,主要由sp3碳和sp2碳组成的新型零维碳纳米材料。CDs优良的荧光性能、生物相容性以及表面易功能化等特点拓宽了其在生物医学抗菌应用领域的潜力。Stankovic等[17]以聚氧乙烯聚氧丙烯共聚物为原料,通过水热法制得疏水性CDs,发现其在470 nm波长蓝光照射下可以产生单线态氧,能够对大肠杆菌和金黄色葡萄球菌产生抗菌作用,并且在蓝光照射下能阻碍细菌膜的形成,起到抗微生物堆积作用。Jian等[18]以亚精胺为原料通过水热法制得带正电荷的CDs,对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌以及耐甲氧西林金黄色葡萄球菌都具有良好的抗菌性,并通过实验验证了其良好的生物相容性。在此研究基础上,他们还构建了金黄色葡萄球菌感染所致的角膜炎动物模型进行治疗,结果显示该CDs对细菌性角膜炎能够起到一定的治疗效果。近年来,各种不同功能化的CDs也逐渐得到发展。Dou等[19]利用葡萄糖和线型聚乙烯亚胺为原料合成了胺基化的CDs,再与溴化苄反应得到表面修饰季铵基团的CDs,发现该CDs对金黄色葡萄球菌和大肠杆菌都具有很强的抗菌作用。Yang等[20]以甘油和二乙烯三胺基丙基三甲氧基硅烷为原料,通过热熔法得到表面修饰胺基的CDs,再与十二烷基二甲基甜菜碱(BS-12)偶联得到具有多色荧光发射特性的CDs,其对革兰阳性菌产生特异性抗菌作用,并能选择性地对该类细菌进行荧光成像,实现与革兰阴性菌的鉴别。随着对CDs研究的增多,CDs已展现出在医学抗菌领域中广阔的应用前景。
2 抗菌机理
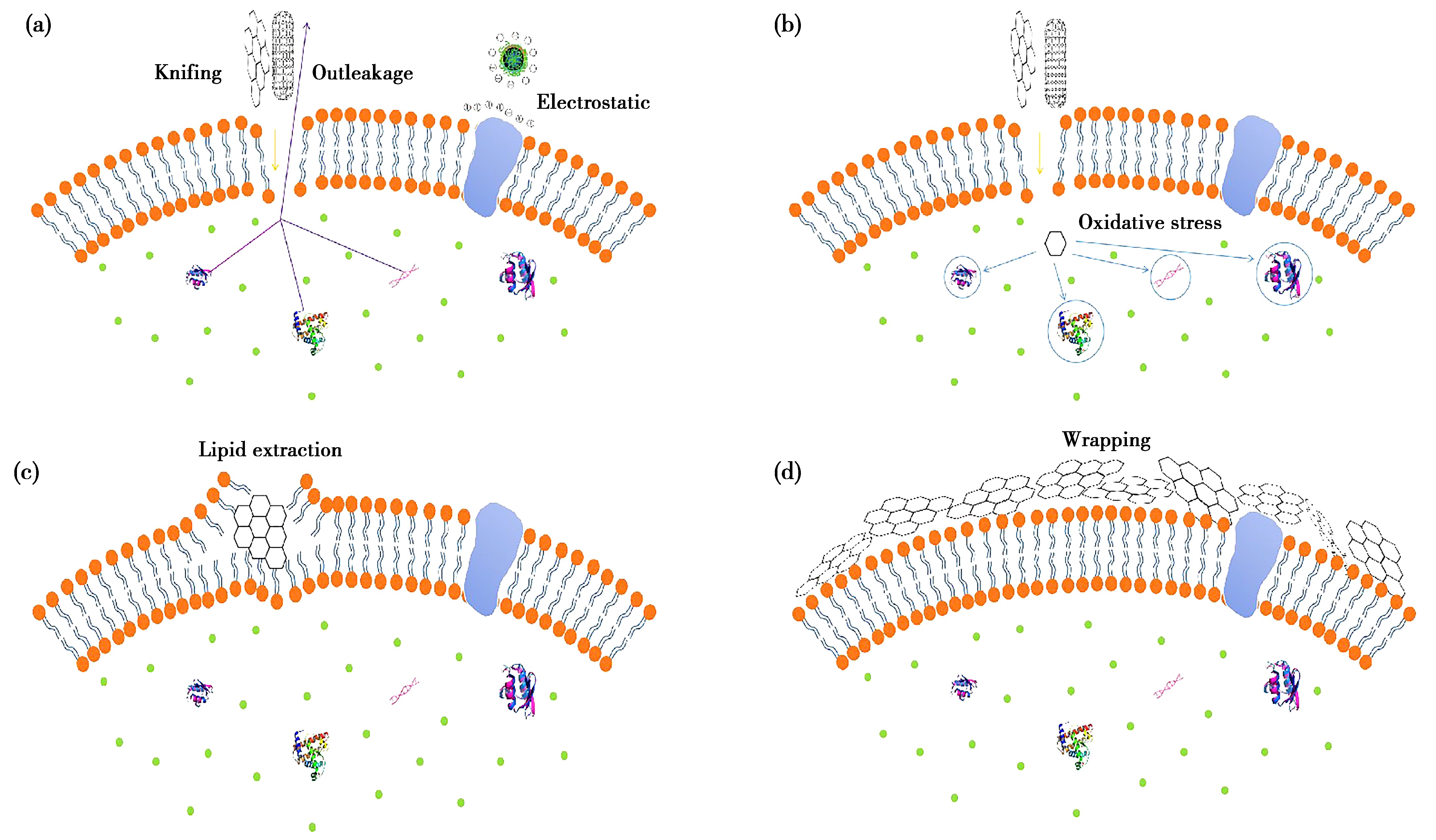
碳纳米材料的抗菌活性主要取决于其独特的理化性质,独特的形态、大小和表面功能基团。随着对碳纳米材料抗菌活性的研究发现,目前存在的几个主要的抗菌活性机制假说已得到广泛认可,主要包括:物理损伤、氧化应激、脂质萃取以及隔离包裹等机制(图2)。
2.1 物理损伤
碳纳米材料可以通过对细菌外膜或细胞壁的破坏产生机械损伤作用,从而起到抗菌、抑菌作用。Li等[21]通过研究柠檬酸铵热解所得的亚精胺封端的CDs抗菌机理发现,CDs所带正电荷可以通过氢键和静电相互作用与细胞膜上的肽聚糖、蛋白质和孔蛋白结合,抑制细胞膜的合成,引起细菌死亡从而发挥杀菌作用。Kang等[22]检测了CNTs与细菌的相互作用,发现当细菌与CNTs直接接触时,其细胞形态会发生畸变,使细胞膜受损,胞内物质流出,细菌细胞失去功能,所以CNTs表现出优良的抗菌性能。Liu等[23]把CNTs称为移动的“纳米飞镖”,形象地描述了CNTs的机械杀菌作用。对于GMs,有研究证实GMs会穿透微生物的细胞膜造成胞内物质泄漏,最终导致局部物理破坏甚至是微生物的死亡[24],这一机制被形象地称为“纳米刀”锋利边缘的切割作用,有时也被称为“切入模式”或“渗透模式”,这种锋利的边缘能够对微生物的细胞壁或细胞膜造成一定的损伤,导致细菌细胞膜完整性的缺失和遗传物质的泄漏。
不同维度的碳纳米材料均可对细菌外膜或细胞壁造成机械损伤。零维、一维、二维碳纳米材料与细菌外膜或细胞壁的接触作用类似于点、线和面与菌体界面的相互作用,机械损伤的强度也会因维度的不同而发生改变。
2.2 氧化应激
碳纳米材料诱导氧化应激发生是另一种被广泛认可的抗菌机制假说,是指通过破坏菌体内强氧化剂和抗氧化剂之间的平衡而导致对细菌的伤害。石墨烯纳米材料基于氧化应激形成的细胞毒性或抑菌性机理早年一直有被报道。Zhang等[25]报道过石墨烯的细胞毒性是基于氧化应激,也有研究认为氧化应激是碳纳米管主要的抑菌机理之一[26],其主要是通过CNTs介导了谷胱甘肽的氧化引起的[27]。胞内氧化应激过程能干扰细菌的基本代谢并破坏其基本的细胞功能,最终导致细胞失活甚至细胞死亡。氧化应激过程主要通过ROS或非ROS依赖性途径产生,前者由胞内ROS(如超氧化物、过氧化氢、羟自由基或单线态氧)的过度累积所诱导。大量研究表明ROS能诱导胞内蛋白失活、脂质过氧化反应、线粒体功能障碍、胞膜降解,最终导致细胞坏死或凋亡[28]。而非ROS依赖性氧化应激则是指在不产生ROS情况下细胞重要结构或胞内组分的破坏或氧化过程,这是独立于ROS的一种氧化应激反应。有研究发现,石墨烯可以作为电子受体发挥电子泵的作用,接受来自于细菌细胞膜上的电子并将其泵出,进而扰乱微生物代谢进程[29]。
2.3 脂质萃取
碳纳米材料与细菌还可通过脂质萃取的方式与微生物产生相互作用。细菌通过脂质膜(革兰氏阴性细菌包括外膜和内膜,而革兰氏阳性细菌只有内膜)摄取营养并且消除有毒物质,膜结构及其功能完整性的破坏将导致细菌被抑制或直接被杀死[30]。与上述机械损伤破坏细菌细胞壁或外膜不同,表面活性位点多的碳纳米材料可以穿透细菌脂质膜,大量的磷脂能从脂质双分子层中被有效地萃取到碳纳米材料表面,最终导致细胞膜完整性损失和细菌死亡。Tu等[31]于2013年通过实验和理论研究,揭示了石墨烯纳米片对细菌细胞膜的脂质提取作用。研究发现,当细菌细胞膜被氧化石墨烯纳米薄片处理时,GO会通过大规模直接抽提细胞膜上的磷脂分子来破坏细胞膜从而杀死细菌。他们通过计算机分子模拟方式分析出,GO的二维平面结构可以通过范德华力和强疏水力与细胞膜上的磷脂分子产生相互作用,使磷脂分子被吸附到GO的表面。Liu和Yi等[32-33]于2015年进一步研究了GO与磷脂双分子层的作用,验证了GO对磷脂有抽提作用,并且这种对磷脂的抽提是与尺寸有关:尺寸越大,效果越好。还有研究发现,这种脂质提取也是CNTs对脂质双分子层的主要损伤机制之一[34]。
2.4 隔离包裹
除了机械损伤作用、氧化应激作用和对细菌胞膜的包裹作用外,一些表面积较大的碳纳米材料还可以包裹细菌将其与营养环境隔离,从而导致细菌失活。在研究聚合石墨烯纳米片的抗菌性能时,Akahavan等[35]首次阐明了这种包裹效应,该效应也能够在CNTs聚集物中观察到[36]。GMs可通过六边形的二维晶体结构提供一种屏障将细菌与它们周围的环境隔离开[37],从而对革兰阳性菌和革兰阴性菌的增殖能力进行抑制。被包裹的细菌虽然能保持完整的形态,但因与其生活环境的分离,使细菌间的物质、信息交流减少,胞内代谢水平和细胞活力降低,细菌无法增殖,与此同时GMs包裹细菌会对细菌细胞膜产生一定程度的破坏。Chen等[38]通过研究提出,GO是通过包裹、缠绕住微生物,造成其细菌胞膜去极化或电解质的泄漏从而达到抗菌的目的。除此之外,还发现大于5.2 nm的石墨烯纳米片可因为石墨烯与脂质双分子层的强疏水作用附着在细菌的膜上,尺寸更大且分散性更好的GO纳米片则能轻易地包裹细菌并且阻止胞膜上的活跃位点,从而抑制细菌的增殖,降低其生存能力[39]。
3 碳纳米抗菌材料在生物医学方面的应用研究
3.1 应用研究现状
综上所述,碳纳米材料由于其卓越的抗菌性能在医用抗菌领域展现出巨大的应用价值。目前已在口腔疾病、抗菌敷料、组织工程等领域得到了越来越多的应用与研究。
3.1.1 口腔疾病
在口腔医学领域中,牙龈卟啉单胞菌是牙周炎的关键致病菌,通过CDs表面正电荷与牙龈卟啉单胞菌表面负电结构相互作用诱导杀菌,控制感染,从而达到治疗龋病和牙周疾病的效果。Liu等[40]2017年初第一次研究了荧光CDs对口腔内专性厌氧菌牙龈卟啉单胞菌的抗菌作用,研究以甲硝唑为前驱体,通过一步水热法合成荧光CDs,发现浓度为1.25 μg/mL的荧光CDs对牙龈卟啉单胞菌的抑菌率达到71.7%,且随CDs浓度增加,抑制作用增强。该发现对龋病和牙周病诊断、治疗和预防等有重要意义,为荧光CDs对口腔细菌的研究开辟了道路。
3.1.2 抗菌敷料
一直以来,开发能够抑制微生物感染的生物材料在医学领域都具有重要的作用。研究发现,聚合物官能化的CNTs可以被用作抗微生物活性材料[41],如各种生物医学装置和伤口敷料涂层。Simmons等[42]制得的单壁CNTs涂层聚乙烯吡咯烷酮-碘(聚维酮碘)可以达到对大肠杆菌较高的抗菌活性,然后将该生物材料用作导电纳米绷带,发现其具有高灵活性和抗菌性能,可减少创伤处细菌的数量,有利于伤口愈合。此外,氨基酸(精氨酸、赖氨酸)功能化的CNTs以及抗菌多肽功能化的CNTs都显示出优异的抗菌性能[43-45],有望开发成为优异的抗菌生物医用材料。
3.1.3 组织工程
感染性骨缺损是骨科感染疾病中的难点,主要继发于巨大暴力作用下导致的严重开放性骨折,伤口往往受到不同程度污染,软组织、血运损伤严重,并伴随大量的骨质丢失。急需开发一种具有一定抗菌活性、可控缓释药物并具备良好成骨活性的植骨材料,用于开放性骨折后感染及骨缺的治疗。翁蔚宗等[46]在石墨烯复合三维支架材料上负载抗生素,充分发挥石墨烯良好的性能,形成兼具骨填充修复及抗菌性的局部缓释系统,提高药物有效浓度,同时降低药物副作用,为治疗开放性骨折导致的感染性骨缺损提供新的思路。
3.2 应用前景展望
导尿管相关尿路感染(Catheter associated urinary tract infections,CAUTI)主要是指患者留置导尿管后,或者拔除导尿管48 h内发生的泌尿系统感染,是一种极为常见的医院内感染,约占医院内感染的40%。留置导尿管的病人中有30%的病人因导尿管相关性尿路感染而出现泌尿系统或全身症状,有4%的患者发生菌血症,死亡率可高达30%,严重影响患者的生活质量和生命安全[47-48]。因此,对导尿管进行一定的表面处理,改进其抗菌性能以防止尿路感染,具有重要的临床意义。
为了预防导尿管相关性感染,用银系无机抗菌剂处理的导尿管已实现商品化,如美昕医疗器械(上海)有限公司生产的银离子亲水涂层硅胶导尿管(沪食药监械(准)字2014第2661258号),其抗菌效果强、耐热且不易使细菌产生耐药性。但到目前为止,用银系材料替代抗生素药物治疗并不是最完美的解决方案。首先,Ag可能在组织中积累,而Ag离子(Ag+)在高剂量或长期使用时可能引起局部或全身的毒副作用,包括过敏反应而导致的尿路不适症状以及细胞毒性等[49-50]。此外,纳米银颗粒因具有较高的表面活性而极易团聚、易氧化、稳定性差,且存在银释放过快等问题,这些问题都将影响纳米银的高效抗菌和持久抗菌特性。而CNTs、GMs和CDs等抗菌纳米材料可以通过多种“物理化学”途径的组合作用来破坏细胞外膜,使它们在延缓微生物耐药性的发展方面具有独特的优势[51-55]。另外,碳纳米材料都具有独特的理化性质,这使得它们在设计抗菌复合材料方面具有非常大的应用价值。鉴于以上碳纳米抗菌材料优异的抗菌性能,有望将碳纳米材料应用于抗菌导尿管的研究中,以降低导尿管伴随性尿路感染的发生率。然而,与纳米银相比,抗菌碳纳米材料的唯一诟病就是在生物医学应用方面还处于起步阶段,对其生物安全性还未得到充分的评价。
4 结语
超级细菌的出现,使得细菌感染治疗越来越棘手。碳纳米材料具有的抗菌性及其特有的物理抗菌作用让研究者们在抗生素滥用的时代里看到了新的曙光。如果能将其应用于抗菌药物,就有可能彻底解决细菌的耐药性问题。
虽然通过对碳纳米材料抗菌作用的广泛研究,已经证实碳纳米材料具有抗菌性能,但将碳纳米材料应用于实际抗菌应用中还有许多尚待解决的问题。例如:(1)碳纳米材料对人体细胞和组织的潜在毒性尚未得到充分的评估;(2)碳纳米材料在细菌中的精确定位尚未得到充分的探索,碳纳米材料对细菌作用的选择性低。总之,研发一种新型材料,在新领域推广应用,都要全面了解它的性能,评估它的安全性,这样才能持之以恒发展。我们有理由相信,大力挖掘碳纳米材料的抗菌活性,拓展其应用领域,将会极大造福人类健康。
参考文献
[1] Noorden R V. Nature,2011,469(2),14.
[2] Iijima S. Nature,1991,354(6348),56.
[3] Kang S,Pinault M,Pfefferle L D,et al. Langmuir,2007,23(17),8670.
[4] Arias L R,Yang L. Langmuir,2009,25(5),3003.
[5] 孟洁,郭小天,孔桦,等.基础医学与临床,2010,30(9),897.
[6] Michael M. Materials,2016,9(8),617.
[7] Ji H W,Sun H J,Qu X G. Advanced Drug Delivery Reviews,2016,105,176.
[8] Palmieri V,Bugli F,Lauriola M C,et al. ACS Biomaterials Science&Engineering,2017,3(4),619.
[9] Novoselov K S. Science,2004,306(5696),666.
[10] Hu W,Peng C,Luo W J,et a1. ACS Nano,2010,4(7),4317.
[11] Akhavan O,Ghaderi E. ACS Nano,2010,4(10),5731.
[12] Liu S B,Zeng T H,Hofmann M,et al. ACS Nano,2011,5(9),6971.
[13] Yang J,Zang C L,Sun L,et al. Materials Chemistry Physics,2011,129(1-2),270.
[14] Cai X,Lin M S,Tan S Z,et al. Carbon,2012,50(10),3407.
[15] Tang J,Chen Q,Xu L G,et al. ACS Applied Materials&Interfaces,2013,5(9),3867.
[16] Xu X,Ray R,Gu Y,et al. Journal of the American Chemical Society,2015,126(40),12736.
[17] Stankovic N K,Bodik M,Siffalovic P,et al. ACS Sustainable Chemistry&Engineering,2018,6(3),4154.
[18] Jian H J,Wu R S,Lin T Y,et al. ACS Nano,2017,11(7),6703.
[19] Dou Q,Fang X,Jiang S,et al. RSC Advances,2015,5(58),46817.
[20] Yang J J,Zhang X D,Ma Y H,et al. ACS Applied Materials&Interfaces,2016,8(47),32170.
[21] Li Y J,Harroun S G,Su Y C,et al. Advanced Healthcare Materials,2016,5(19),2545.
[22] Shvedova A,Castranova V,Kisin E,et al. Journal of Toxicology and Environmental Health,2003,66(20),1909.
[23] Liu S B,Wei L,Hao L,et al. ACS Nano,2009,3(12),3891.
[24] He J L,Zhu X D,Qi Z N,et al. ACS Applied Materials&Interfaces,2015,7(9),5605.
[25] Zhang Y B,Ali S F,Dervishi E,et al. ACS Nano,2010,4(6),3181.
[26] Kang S,Herzberg M,Rodrigues D F,et al. Langmuir,2008,24(13),6409.
[27] Vecitis C D,Zodrow K R,Kang S,et al. ACS Nano,2010,4(9),5471.
[28] West J D,Marnett L J. Chemical Research in Toxicology,2006,19(2),173.
[29] Li J H,Wang G,Zhu H Q,et al. Scientific Reports,2014,4,4359.
[30] Mingeot-Leclercq M P,Décout J L. Med Chem Comm,2016,7,586.
[31] Tu Y S,Lv M,Xiu P,et al. Nature Nanotechnology,2013,8(8),594.
[32] Liu X T,Chen K L. Langmuir,2015,31,12076.
[33] Yi P,Chen K L. Environmental Science&Technology,2013,47(11),5711.
[34] Zhu W P,Annette V D B,Yi X,et al. Proceedings of the National Academy of Sciences,2016,113(44),12374.
[35] Akhavan O,Ghaderi E,Esfandiar A. The Journal of Physical Chemistry B,2011,115(19),6279.
[36] Chen H,Wang B,Gao D,et al. Small,2013,9(16),2735.
[37] Mejías Carpio I E,Santos C M,Wei X,et al. Nanoscale,2012,4(15),4746.
[38] Chen J N,Peng H,Wang X P,et al. Nanoscale,2014,6(3),1879.
[39] Dallavalle M,Calvaresi M,Bottoni A,et al. ACS Applied Materials&Interfaces,2015,7(7),4406.
[40] Liu J J,Lu S Y,Tang Q L,et al. Nanoscale,2017,9(21),7135.
[41] Lu S W,Feng C L,Nie P,et al. Journal of Aeronautical Materials,2015,35(2),12.
[42] Simmons T J,Lee S H,Park T J,et al. Carbon,2009,47(6),1561.
[43] Zardini H Z,Amiri A,Shanbedi M,et al. Colloids&Surfaces B Biointerfaces,2012,92(4),196.
[44] Dong X L,Mc Coy E,Mei Z,et al. Journal of Environmental Sciences,2014,26(12),2526.
[45] Aslan S,Deneufchatel M,Hashmi S,et al. Journal of Colloids&Interface Science,2012,388(1),268.
[46] 翁蔚宗.碳纳米材料治疗开放骨折后感染性骨缺损及伤口疤痕的研究.博士学位论文,第二军医大学,2017.
[47] 郑奋薇,蔡桂程,梁美莲,等.解放军医学院学报,2018,39(6),494.
[48] 李霞.实用临床医学,2013,14(11),111.
[49] Marx D E,Barillo D J. Burns,2014,40,S9.
[50] Rizzello L,Pompa P P. Chemical Society Reviews,2014,43,1501.
[51] Zou X F,Zhang L,Wang Z J,et al. Journal of the American Chemical Society,2016,138(7),2064.
[52] Szunerits S,Boukherroub R. Journal of Materials Chemistry B,2016,4,6892.
[53] Al-Jumaili A,Alancherry S,Bazaka K,et al. Materials,2017,10(9),1066.
[54] Wang L L,Hu C,Shao L Q. International Journal of Nanomedicine,2017,12,1227.
[55] Huh A J,Kwon J Y. Controlled Release,2011,156(2),128.

