摘 要:活髓保存治疗是尽最大限度保留健康牙髓组织、提高患牙远期保存率的方法,但其被认为适应范围有限,疗效不确定。牙髓组织的病理学改变是决定临床治疗方案和评估疗效的组织学基础,而常用的检查方法无法全面反映牙髓的病理学改变。随着对牙髓生物学研究的深入、现代诊疗技术及盖髓材料的革新,活髓保存治疗越来越多地被应用在以往被认为需要摘除牙髓的患牙上。本文根据循证文献,就牙髓炎病理改变、恒牙牙髓炎活髓保存治疗的临床研究等方面进行分析讨论和总结。在活髓保存治疗的过程中综合运用包括激光多普勒血流仪、组织氧检测仪、核磁共振成像、牙科显微镜等技术与方法准确判断牙髓炎症状态,并依此决定牙髓的去留程度;结合严格的感染控制与高生物相容性盖髓材料的使用,活髓保存治疗可运用在部分龋源性露髓患牙与出现不可复性牙髓炎症状的恒牙上。未来的研究则需从牙髓修复再生机制、牙髓炎诊断精准化、盖髓材料的升级等方面提高恒牙牙髓炎活髓保存治疗的成功率。
关键词:牙髓炎 恒牙 活髓保存治疗 直接盖髓术 牙髓切断术 适应证 预后 防御反应 修复反应 激光多普勒血流仪 组织氧检测仪 核磁共振成像 盖髓材料
Vital pulp therapy of pulp inflammation of permanent teeth
WU Buling LUO Yifei XU Wenan TONGZhongchun
Department of Cariology and Endodontics, Shenzhen Stomatology Hospital (Pingshan), Southern Medical University; College of Stomatology, Southern Medical University; Depart-ment of Operative Dentistry and Endodontics, Hospital of Stomatology, Sun Yat-sen University;
Abstract:Vital pulp therapy aims to maintain healthy pulp tissue as much as possible to improve the long-term survival of teeth. It has limited indications and uncertain curative effects. The pathological changes in inflamed pulp are the histological basis for the determination of treatment strategies and the treatment outcome; however, pulp sensitivity testing cannot reflect the actual histological status of the pulp. With the development of basic and clinical research on vital pulp therapy, the innovation of modern diagnostic and therapeutic technology and capping material, vital pulp therapy can be used as a treatment of teeth on which it was previously thought pulpectomy was necessary. Based on the evidence-based literature, this paper analyzes and summarizes the pathological changes of pulpitis and clinical research on the treatment of pulpitis. Vital pulp therapy can be a treatment for mature teeth with carious exposure and symptoms of irreversible pulpitis if comprehensive applications, including laser Doppler flowmetry, tissue oxygen monitoring, magnetic resonance imaging and microscopy, are used to determine the degree of pulp retention and if infection control and the use of biocompatible capping material are emphasized. In the future, it will be necessary to improve the success rate of vital pulp therapy for the treatment of pulpitis through research on the mechanism of pulp repair and regeneration, the precise diagnosis of pulpitis, and the development of pulp capping materials.
Keyword:pulpitis; permanent teeth; vital pulp therapy; direct pulp capping; pulpotomy; indication; prognosis; defease reaction; repair reaction; laser doppler flowmetry; tissue oxygen monitor; magnetic resonance imaging; pulp capping material;
牙髓是位于牙体硬组织内的疏松结缔组织,承担形成、营养、感觉、防御四大功能;保护和保存活髓有利于维护牙髓的生理功能。细菌感染及临床诊治中的物理和化学刺激是引起牙髓炎的常见病因。以往研究认为,炎症在牙髓中易于扩散,牙髓组织修复再生能力差,当恒牙出现不可复性牙髓炎的症状后,绝大部分病例需摘除牙髓,进行完善的根管治疗。
活髓保存治疗(vital pulp therapy,VPT)是以保存牙髓活性为目的,通过促进修复性牙本质形成,消除牙髓炎症的治疗方法;其适应证窄,多限于牙髓损伤局限或可逆时;诊断为不可复性牙髓炎的恒牙难以保存活髓[1]。然而,牙髓组织的病理学改变是决定牙髓炎治疗方案与评估疗效的组织学基础,而患者的临床症状与常用的检查方法都不能全面地反映牙髓的病理学改变[2]。此外,炎症状态下牙髓的防御机制活跃,多种细胞参与牙髓-牙本质复合体的修复与再生。随着对牙髓组织的炎症反应及其自身修复机制研究的深入、辅助技术以及盖髓材料的升级,越来越多的学者尝试针对炎症牙髓采用活髓保存治疗。本文将对牙髓炎的病理学改变、牙髓的防御机制与自我修复能力、恒牙活髓保存治疗预后等方面进行总结讨论,为临床医师对牙髓炎患牙采用活髓保存治疗提供参考。
1 牙髓炎的病理学改变
引起牙髓炎的病因包括细菌感染、机械损伤以及治疗过程中的物理化学刺激等,其中龋病导致的细菌侵入与感染是最常见的病因。细菌对牙髓组织的侵入与感染是一个动态的过程,牙髓由健康状态变为炎症状态,牙髓的炎症程度由轻至重,发生的范围由小至大。活髓保存治疗需要去除感染病灶并控制炎症反应,细菌引起牙髓组织炎症程度及范围与活髓保存治疗的成功密切相关,牙髓的炎症状态与其病理学改变有良好的相关性,了解牙髓炎发生发展的病理学机制具有重要意义[3]。
1.1 牙髓健康状态
从龋损的形成开始,细菌不断向牙髓腔的方向深入。早期的釉质龋引起的牙髓反应不显著,牙髓处于正常生理状态,细菌尚未侵入牙髓组织,但细菌及其毒力因子可以通过牙本质小管对牙髓产生刺激,其相应部位可形成结构正常的第三期牙本质。
1.2 牙髓的早期炎症反应
随着龋损接近或到达釉牙本质界,细菌及其毒力因子对牙髓产生的刺激增强,但细菌尚未侵入牙髓组织,病理学上将此诊断为可复性牙髓炎[4]。牙髓出现早期的炎症反应,对应部位的成牙本质细胞减少,组织局部充血,树突状细胞在此处聚集。此阶段如果能去除对牙髓造成刺激的病因,提高牙髓组织自我抵抗及修复的能力,则保存活髓是可行的。
1.3 牙髓冠部的局限感染
龋损继续朝髓腔的方向进展,当细菌进入并定植在牙髓组织时,此处的牙髓组织出现小范围的坏死,病理学上认为该处的牙髓病变处于不可逆阶段[4]。Ricucci等[4]发现,细菌入侵牙髓组织的早期,细菌定植及炎症波及的范围局限在邻近龋损部位的组织;中性粒细胞出现在坏死区域,形成“微脓肿(micro-abscess)”,周围大量的巨噬细胞和淋巴细胞等炎症细胞将其包裹,其与对侧以及深处健康无菌的牙髓组织分界显著。Lin等[5]发现距离坏死的牙髓组织数毫米远的牙髓组织通常不受细菌及炎症侵犯。因此,当牙髓感染的范围局限时,若能彻底去除细菌侵袭及组织坏死的部分,对剩余牙髓组织采取适当的保髓治疗,剩余的牙髓组织仍可以维持正常的生理功能。
1.4 牙髓根部的感染
随着冠部感染扩散,细菌向根部侵入,当绝大部分甚至整个牙髓组织坏死时,细菌聚集在坏死组织中,病理学上诊断为牙髓坏死[3]。此时不宜保存活髓,需要彻底清除髓腔及根管内的感染,预防感染向根尖周组织扩散。
目前,牙髓炎的分类以治疗方法的选择为导向,医师通过临床检查结果及患者的主观症状推断牙髓组织的炎症状态,根据刺激去除后炎症牙髓恢复正常状态的可能性大小分为“可复性牙髓炎”与“不可复性牙髓炎”。然而,Ricucci等[3]发现有15.6%临床诊断为不可复性牙髓炎的患牙与病理学的诊断不一致。牙髓组织感染的程度及范围在不同患牙间有较大差异,而且牙髓组织的感染范围与患牙的龋坏程度、患者的疼痛程度并不一致,患牙在保髓治疗前的临床症状也与其预后没有绝对的联系[5]。笔者认为,目前牙髓炎的临床分类无法准确反映牙髓的炎症状态,“不可复性牙髓炎”不能用于形容整个牙髓组织恢复不可逆的状态,“不可复性”只能反映细菌侵入部位的牙髓组织炎症是不可逆,对于感染未累及深部根髓组织或感染可以控制的患牙,可以通过彻底清除冠部牙髓感染组织,保留剩余的牙髓活力。牙髓炎的临床分类与诊断需进一步探索,尽可能准确反映牙髓的炎症状态,为活髓保存治疗提供临床指导。
2 炎症牙髓的修复与再生
细菌及其毒力因子引发了牙髓的防御反应,使牙髓组织处于炎症状态,这为后续牙髓-牙本质复合体的修复和再生创造了条件[6],牙髓组织的防御及修复机制是炎症牙髓活髓保存的生物学基础。
2.1 牙髓的防御反应
活髓牙的牙本质渗透性低于无髓牙,牙本质小管内的细胞突起及牙本质液依靠牙髓组织与外界的压力梯度,可以阻挡细菌与毒素的入侵[7]。牙髓组织具有丰富的微循环,炎症状态下扩张的血管将炎症细胞、营养成分及氧气转运至牙髓中,并将有害物质转运出牙髓,也为后续牙髓-牙本质复合体的修复提供基础[8-10]。
细菌入侵产生的脂多糖、胞壁酰二肽以及脂磷壁酸可被牙髓中常驻在血管周围及成牙本质细胞下层的树突状细胞的模式识别受体(pattern recognition receptor,PRR)所识别[11-12],启动宿主免疫反应。成牙本质细胞还能分泌抗菌物质、趋化因子、细胞因子等引发进一步的牙髓防御反应[13]。随扩张的血管转运而来的T淋巴细胞、B淋巴细胞也在牙髓的慢性炎症过程中发挥了特异性免疫防御的功能[8]。牙髓组织丰富的防御反应为炎症牙髓活髓保存治疗后清除剩余感染提供保障,也为牙髓的修复及再生建立基础。
2.2 牙髓的修复反应
炎症状态下牙髓产生的多种信号分子除了调控防御反应外,也启动了牙髓的修复反应[8],而炎症牙髓的修复反应是牙髓-牙本质复合体的再生的前提。
牙本质脱矿崩解时,牙本质基质中释放骨形成蛋白(bone morphogenetic protein,BMP)、转化生长因子β(transforming growth factor-β,TGF-β)等生物活性分子,刺激成牙本质细胞形成牙本质[14-15];炎症反应产生的基质细胞衍生因子(stromal cellderived factor-1,SDF-1)、基质金属蛋白酶(matrix metalloproteinases,MMPs)对牙髓干细胞的召集、增殖、分化有重要作用[16-17]。炎症状态下牙髓干细胞有较活跃的增殖和分化潜能[18]。牙髓干细胞能调节巨噬细胞的功能,而巨噬细胞能分泌多种生长因子,促进牙髓组织的修复[8,19-20],这表现了牙髓组织具有平衡炎症与修复的潜能。然而,感染的牙髓组织修复能力大于再生能力,新形成的修复性牙本质在结构与形态上与继发性牙本质、反应性牙本质不同,成牙本质细胞的形态也发生了改变[21]。炎症牙髓有自我调节及修复的潜能,牙髓炎的活髓保存治疗需要从牙髓-牙本质复合体的角度出发考虑,通过改进盖髓材料、操作技术等方面,限制牙髓的炎症反应,更好地激发出牙髓的再生潜能。
3 评估牙髓炎症状态的方法与技术
牙髓炎症的严重程度及范围是活髓保存治疗能否成功的重要影响因素,评估牙髓炎症的程度和范围一直是活髓保存治疗的难题之一。尽管牙髓炎症的状态与其病理改变具有良好的相关性,但其难以在临床上运用,目前仅通过临床症状和常用的临床检查结果来判断牙髓炎症的状态或活髓保存治疗的预后仍存在主观性,常导致本可以保存活髓的患牙被排除在外[2]。因此,临床医师需要掌握并熟练运用牙髓炎症评估的技术与方法,在术前合理判断患者的牙髓的炎症状态,术中把握好“去髓”与“保髓”间的平衡,术后全面评估牙髓活力。
3.1 由残余牙本质厚度预测牙髓炎症状态
医师可以通过影像学检查测量龋损与牙髓间残存牙本质的厚度预测牙髓的炎症状态。一般认为,残存牙本质厚度大于1 mm时,牙髓可以抵抗来自外界的毒力刺激;当厚度小于0.5 mm时,牙髓的炎症反应加重;当厚度小于0.25 mm时,即使没有显著的穿孔,细菌也可通过牙本质小管进入牙髓,炎症反应严重,甚至有“微脓肿”形成[22]。
3.2 显微镜直视下判断牙髓状态
对于龋源性露髓的患牙,Ricucci等[4]与Lin等[5]提出医师在活髓保存治疗过程中需要借助显微镜,仔细观察露髓处周围牙本质形态、牙髓组织的颜色及质地、创面出血及止血情况,判断牙髓炎症的范围与状态,从而决定去髓的程度。当牙髓创面颜色苍白暗淡、组织结构异常时,说明该处牙髓组织已无活力,需要去除;当牙髓组织周缘处的牙本质发软或有牙本质碎屑污染牙髓创面时,也需要去除该处的组织,以防感染;牙髓创面的出血若经高浓度次氯酸钠处理后无法在5 min内止血,则说明该处牙髓组织炎症程度较重,需要进一步去除。
3.3 激光多普勒血流仪(laser doppler flowmetry,LDF)与组织氧检测仪(tissue oxygen monitor,OXY)
临床常用的温度测试、电活力测试只能检测牙髓对不同刺激的神经反应,并不能检测牙髓的血运循环状态,而活髓保存治疗的预后与牙髓血运循环的状态有重要联系[5]。LDF与OXY可以通过非侵入性的方式检测牙髓血流量与血氧饱和度。Mainkar等[23]通过meta分析发现相比临床常用的电活力测试与温度测试,LDF与OXY可以更准确的反映牙髓活力,二者的联合运用为判断牙髓状态提供可靠的指导。然而,目前LDF的应用仍存在技术要求高、成本高以及只能检测在龈缘以上的髓腔内的血流量等问题;而OXY目前只能检测未露髓的患牙,这些局限影响了LDF与OXY在活髓保存治疗中的应用[23]。
3.4 核磁共振成像(magnetic resonance imaging,MRI)
近年MRI越来越多地应用在牙体牙髓病的诊断与预后追踪。MRI相比根尖片、锥形束CT等传统的影像学检查手段具有多方位、多参数成像的优势,对软组织的识别与分辨能力强[24]。MRI可以检测牙髓的形态、活力及再生情况,可以更好地反映牙髓的炎症状态。健康牙髓表现为中高信号;炎症牙髓为高信号;坏死牙髓为低信号。另外,MRI的4D成像还可以评估牙髓的血流状态,为临床医师观察牙髓的活力及炎症状态提供指导[25]。
3.5 牙髓血液中的生物标志物
牙髓炎发生时,牙髓血液中炎症相关的生物标志物会增加,找到可以判断牙髓炎症程度的生物标志物,有助于辅助牙髓炎的诊断。检测的方法包括收集患牙牙本质小管液或龈沟液,收集牙髓的血液或根尖周组织液[26],前者属于非侵入性的方法,而后者是侵入性的。牙本质小管液与牙髓血液检测的结果更能反映牙髓的炎症状态。Zanini等[27]分析发现炎症牙髓中白细胞介素-8(interleukin-8,IL-8)、基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)、肿瘤坏死因子-α(tumor necroptosis factor-α,TNF-α)及晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)的表达增加,在可复性与不可复性牙髓炎之间存在显著差异。随后,Hirsch等[28]提出白细胞介素-6(interleukin-6,IL-6)与TNF-α可作为诊断不可复性牙髓炎的标志物。IL-8、MMP-9、TNF-α及IL-6均与中性粒细胞功能的调控有关,这些因子的表达增高可能预示着炎症的扩大[27,29-30]。然而,这类研究未将标志物的表达水平与牙髓的病理学改变间建立联系。未来的研究除了需要收集大量不同炎症程度的样本进行分析外,还需要开发能够便利收集牙本质小管液或牙髓血液的非侵入性手段及技术。
总而言之,目前缺乏明确的方法或技术可以准确判断牙髓的炎症状态或范围,建议临床医师结合上述提及的多种评估炎症状态的方法与技术,判断牙髓的状态,选择合理的治疗策略,实现炎症牙髓的保存。未来评估牙髓炎症状态的方法与技术需要朝可视化、精准化的方向发展,使临床诊断与病理学诊断尽可能一致。
4 活髓保存治疗方法及适应证
活髓保存治疗的方法主要包括:盖髓术(pulp capping)与牙髓切断术(pulpotomy)。Lin等[5]回顾相关的临床研究发现,近年来活髓保存治疗用于治疗龋源性露髓恒牙及出现不可复性牙髓炎症状的患牙的成功率较高,活髓保存治疗可成为部分“不可复性牙髓炎”病例根管治疗的替代方案。
4.1 盖髓术
根据盖髓材料覆盖在接近牙髓的牙本质表面或已暴露的牙髓创面,盖髓术可分为间接盖髓术与直接盖髓术。多位学者尝试利用直接盖髓术处理龋源性露髓的患牙或出现不可复性牙髓炎症状的患牙。Lin等[5]系统回顾了有关直接盖髓术治疗龋源性露髓恒牙的临床研究,追踪时长1~5年,成功率为73.2%。Ricucci等[4]对507例龋源性露髓的患牙行直接盖髓术,随访时长3~30年,成功率为37%~94.7%。
4.2 牙髓切断术
牙髓切断术是指去除炎症的牙髓组织后,以盖髓材料覆盖于牙髓断面上,促进牙髓断面的愈合及修复,以保留剩余牙髓组织活力的方法。近年来利用牙髓切断术治疗恒牙不可复性牙髓炎已成为国内外的研究热点。Lin等[5]系统回顾了应用牙髓切断术治疗出现不可复性牙髓炎症状恒牙的临床研究,观察时长为14个月~5年,成功率为77.8%~96.4%。Zanini等[31]通过meta分析方法分析了龋源性露髓、诊断为不可复性牙髓炎的恒牙进行牙髓切断术的结果,观察时长6个月~10年,成功率为42%~100%。Asgary等[32-34]的临床随机对照试验选取了407名研究对象,追踪牙髓切断术治疗不可复性牙髓炎恒牙1、2、5年的疗效,成功率分别为97.6%、86.1%、78.1%,其成功率与根管治疗组相比无显著差异。由此可见,仅凭临床症状不能作为评判适应证的标准;活髓保存治疗可以应用于龋源性露髓恒牙及有不可复性牙髓炎症状的恒牙,但仍需大样本、前瞻性、随机对照的临床研究与循证依据,才能指导临床实践[35-38]。
目前,学者们对于恒牙牙髓炎活髓保存治疗的预后标准及随访时长尚未达成共识,这主要由于临床研究的纳入标准、患牙的炎症程度、治疗过程、评估项目等尚未统一。2019年欧洲牙髓病学学会(European Society of Endodontology,ESE)发表的专家共识建议随访的时长至少6个月[39],足够长的随访时间有助于进一步评价疗效[31]。活髓保存治疗的疗效主要围绕临床症状、影像学表现和病理学检查进行评价[4,5,31,34]。病理学检查用于评价牙髓的状态,包括愈合情况及牙本质桥的形成,但临床上常难以实施。临床试验主要以临床及影像学检查作为评价标准。临床治疗成功标准包括牙髓有活力,无疼痛、肿胀及窦道等症状;影像学检查有牙本质桥的形成、无根尖周阴影、无牙根内或外吸收和异常钙化等。笔者认为,临床医师需要随访足够的时间,综合各种评价标准,结合前述评估牙髓状态的方法与技术,才能对活髓保存治疗的疗效做到全面的评估。
5 牙髓炎活髓保存治疗预后的影响因素
5.1 牙髓的炎症状态
活髓保存治疗的术前及术中无法准确判断牙髓的炎症程度及范围、把握牙髓组织的去留程度,是导致治疗失败的主要原因[27]。研究提示,患牙术前的症状对牙髓切断术的成功率无显著影响[40],牙髓暴露后出血量、出血持续时间以及感染的控制则是影响预后的重要因素[5]。若能去除导致感染的因素,即使术前有不可复性牙髓炎症状的患牙也能治愈[37,41],而直接盖髓术处理有不可复性牙髓炎症状的龋源性露髓患牙成功率较牙髓切断术低[42],这可能与感染难以彻底去除有关。此外,患者的年龄与根尖孔的闭合状态不应成为是否采用活髓保存治疗的排除条件,根据患牙的炎症状态选择合适治疗策略才是治疗的关键[38,43-44]。
5.2 盖髓材料
盖髓材料在活髓保存治疗中起关键作用。盖髓材料的选择对间接盖髓术的远期结果无显著影响,但却对直接盖髓术与活髓切断术的远期结果有重要影响[45-46]。
氢氧化钙被作为盖髓材料应用已有较久的历史;氢氧化钙组织兼容性不强,诱导形成的牙本质桥存在许多孔隙,其溶解性高,容易形成微渗漏[47];其直接盖髓的成功率随着追踪时间的延长而下降[48]。因此,推荐使用性能更加卓越的盖髓材料,如矿化三氧化聚合物(mineral trioxide aggregate,MTA)、iRoot BP、生物活性牙本质替代材料Biodentine等。MTA相较氢氧化钙有良好的生物相容性和封闭性,应用于直接盖髓时长期成功率比氢氧化钙高[48];但MTA存在临床操作困难、易使牙冠变色、抗压强度低等缺点[49]。新型的生物陶瓷材料iRoot BP、Biodentine生物相容性对比MTA更高,且不会引起牙冠变色[50-52],在盖髓术与活髓切断术上的应用与MTA的成功率相似[53-54]。
5.3 规范操作
在临床操作过程中注意用橡皮障隔离、严格的无菌操作及术后严密的冠部封闭均能提高活髓保存治疗的成功率[6,38,55]。此外,操作过程中辅以显微镜及激光,有助于去除感染软硬组织,保留剩余健康牙髓组织,促进创面的愈合与修复,体现了“微创”理念[39,56-57]。国内专家根据牙髓损伤的严重程度将治疗难度分为四级,难度越高则越需要有经验的专科医师完成[58],其操作的规范及熟练程度影响活髓保存治疗的预后。
活髓保存治疗所需的技术与材料复杂多样,建议临床医师应根据实际情况,不断了解新技术及材料的特点,正确评估牙髓状态,控制与消除感染,提高牙髓炎患牙活髓保存治疗的成功率。
6 总结与展望
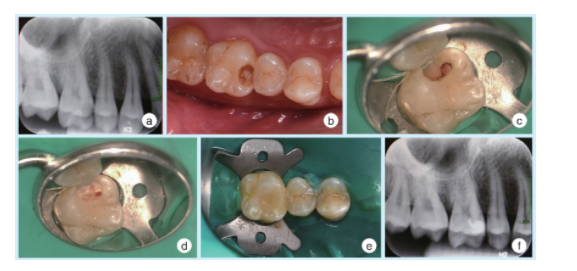
牙髓承担重要的生物学功能,保存活髓是牙体牙髓病治疗的重点之一。笔者综合国内外学者有关活髓保存治疗的专家指南及专家共识[39,58-59],现对牙髓炎活髓保存治疗临床途径的关键进行以下归纳:(1)牙髓状态的评估,术前、术中及术后均需通过多种方法全面评估牙髓的炎症状态,这是选择治疗策略、把握牙髓去留程度、评估治疗效果的前提;(2)感染的清除及预防,需要使用橡皮障隔离,碘伏进行术区消毒,注意无菌操作,这是活髓保存治疗的关键,此外使用牙科显微镜除了有助于感染的清除,亦有助于健康组织的保留(图1);(3)选择合适的盖髓材料及严密的冠部封闭,使用生物相容性高的盖髓材料及严密的冠部封闭可促进损伤牙髓的修复及愈合,避免感染再发生;(4)术后随访,长时间的术后随访有助于评估疗效及决定下一步治疗方案,建议随访时间点为术后1、3、6、12、24、36及48个月。
图1 16牙龋源性露髓后行局部活髓切断术
医师应正确认识牙髓的防御与自我修复能力,准确判断牙髓炎症的程度与范围,选择恰当的治疗策略与技术,活髓保存治疗可以更多地运用在一些“不可复性牙髓炎”的病例中。未来,牙髓炎症状态的诊断需要往全面反映病理状态的方向发展;炎症牙髓修复过程中分子学、细胞学的变化亟待深入研究。活髓保存治疗的疗效需要更多的动物实验及长期、大样本的临床研究进一步观察及评价。保存活髓、促进牙髓-牙本质复合体的修复再生,是牙体牙髓病治疗发展的必然方向。
【Author contributions】Wu BL wrote and reviewed the article.Luo YF wrote the article.Xu WA revised the article.Dong ZC collected the case materials.All authors read and approved the final manuscript as submitted.
参考文献
[1]Al-Hiyasat AS.Barrieshi-Nusair KM,Al-Omari MA.The radiographic outcomes of direct pulp-capping procedures performed by dental students:a retrospective study[J].J Am Dent Assoc,2006,137(12):1699-1705.doi:10.14219/jada.archive.2006.0116.
[2]Crespo-Gallardo I,Hay-Levytska O,Martín-González J,et al.Correction:criteria and treatment decisions in the management of deep caries lesions:is there endodontic overtreatment?[J].J Clin Exp Dent,2019,11(1):e103.doi:10.4317/jced.532742.
[3]Ricucci D,Loghin S,Siqueira JJ.Correlation between clinical and histologic pulp diagnoses[J].J Endod,2014,40(12):1932-1939.doi:10.1016/j.joen.2014.08.010.
[4]Ricucci D,Siqueira JJ,Li Y,et al.Vital pulp therapy:histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure[J].J Dent,2019,86:41-52.doi:10.1016/j.jdent.2019.05.022.
[5]Lin LM,Ricucci D,Saoud TM,et al.Vital pulp therapy of mature permanent teeth with irreversible pulpitis from the perspective of pulp biology[J].Aust Endod J,2020,46(1):154-166.doi:10.1111/aej.12392.
[6]Bjørndal L,Simon S,Tomson PL,et al.Management of deep caries and the exposed pulp[J].Int Endod J,2019,52(7):949-973.doi:10.1111/iej.13128.
[7]Galler KM.Clinical procedures for revitalization:current knowledge and considerations[J].Int Endod J,2016,49(10):926-936.doi:10.1111/iej.12606.
[8]Farges JC,Alliot-Licht B,Renard E,et al.Dental pulp defence and repair mechanisms in dental caries[J].Mediators Inflamm,2015:230251.doi:10.1155/2015/230251.
[9]Giraud T,Jeanneau C,Rombouts C,et al.Pulp capping materials modulate the balance between inflammation and regeneration[J].Dent Mater,2019,35(1):24-35.doi:10.1016/j.dental.2018.09.008.
[10]Luo H,Wang C,Liu M,et al.Inhibition of SOX9 promotes inflammatory and immune responses of dental pulp[J].J Endod,2018,44(5):792-799.doi:10.1016/j.joen.2018.02.004.
[11]Yumoto H,Hirao K,Hosokawa Y,et al.The roles of odontoblasts in dental pulp innate immunity[J].Jpn Dent Sci Rev,2018,54(3):105-117.doi:10.1016/j.jdsr.2018.03.001.
[12]Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.doi:10.1038/ni.1863.
[13]Takahashi N,Nyvad B.Ecological hypothesis of dentin and root caries[J].Br Dent J,2016,221(7):409.doi:10.1038/sj.bdj.2016.732.
[14]Nakashima M,Akamine A.The application of tissue engineering to regeneration of pulp and dentin in endodontics[J].J Endod,2005,31(10):711-718.doi:10.1097/01.don.0000164138.49923.e5.
[15]Da Rosa W,Piva E,Da Silva AF.Disclosing the physiology of pulp tissue for vital pulp therapy[J].Int Endod J,2018,51(8):829-846.doi:10.1111/iej.12906.
[16]Li M,Sun X,Ma L,et al.SDF-1/CXCR4 axis induces human dental pulp stem cell migration through FAK/PI3K/Akt and GSK3β/β-catenin pathways[J].Sci Rep,2017,7:40161.doi:10.1038/srep40161.]
[17]Okamoto M,Takahashi Y,Komichi S,et al.Dentinogenic effects of extracted dentin matrix components digested with matrix metalloproteinases[J].Sci Rep,2018,8(1):10690.doi:10.1038/s41598-018-29112-3.
[18]Goldberg M,Njeh A,Uzunoglu E.Is pulp inflammation a prerequisite for pulp healing and regeneration?[J].Mediators Inflamm,2015:347649.doi:10.1155/2015/347649.
[19]Sonoda S,Yamaza H,Ma L,et al.Interferon-gamma improves impaired dentinogenic and immunosuppressive functions of irreversible pulpitis-derived human dental pulp stem cells[J].Sci Rep,2016,6:19286.doi:10.1038/srep19286.
[20]Lee S,Zhang QZ,Karabucak B,et al.DPSCs from Inflamed Pulp Modulate Macrophage Function via the TNF-α/IDO Axis[J].JDent Res,2016,95(11):1274-1281.doi:10.1177/0022034516657817.
[21]Ricucci D,Loghin S,Niu LN,et al.Changes in the radicular pulpdentine complex in healthy intact teeth and in response to deep caries or restorations:A histological and histobacteriological study[J].J Dent,2018,73:76-90.doi:10.1016/j.jdent.2018.04.007.
[22]Berbari R,Khairallah A,Kazan HF,et al.Measurement reliability of the remaining dentin thickness below deep carious lesions in primary molars[J].Int J Clin Pediatr Dent,2018,11(1):23-28.doi:10.5005/jp-journals-10005-1478.
[23]Mainkar A,Kim SG.Diagnostic accuracy of 5 dental pulp tests:a systematic review and meta-analysis[J].J Endod,2018,44(5):694-702.doi:10.1016/j.joen.2018.01.021.
[24]Niraj LK,Patthi B,Singla A,et al.MRI in dentistry-a future towards radiation free imaging-systematic review[J].J Clin Diagn Res,2016,10(10):ZE14-ZE19.doi:10.7860/JCDR/2016/19435.8658.
[25]Demirturk KH,Geha H,Gaalaas LR,et al.MRI for dental applications[J].Dent Clin North Am,2018,62(3):467-480.doi:10.1016/j.cden.2018.03.006.
[26]Rechenberg DK,Galicia JC,Peters OA.Biological markers for pulpal inflammation:a systematic review[J].PLo S One,2016,11(11):e0167289.doi:10.1371/journal.pone.0167289.
[27]Zanini M,Meyer E,Simon S.Pulp inflammation diagnosis from clinical to inflammatory mediators:a systematic review[J].J Endod,2017,43(7):1033-1051.doi:10.1016/j.joen.2017.02.009.
[28]Hirsch V,Wolgin M,Mitronin AV,et al.Inflammatory cytokines in normal and irreversibly inflamed pulps:a systematic review[J].Arch Oral Biol,2017,82:38-46.doi:10.1016/j.archoralbio.2017.05.008.
[29]Sugiuchi A,Sano Y,Furusawa M,et al.Human dental pulp cells Express cellular markers for inflammation and hard tissue formation in response to bacterial information[J].J Endod,2018,44(6):992-996.doi:10.1016/j.joen.2018.02.022.
[30]Galicia JC,Henson BR,Parker JS,et al.Gene expression profile of pulpitis[J].Genes Immun,2016,17(4):239-243.doi:10.1038/gene.2016.14.
[31]Zanini M,Hennequin M,Cousson PY.A review of criteria for the evaluation of pulpotomy outcomes in mature permanent teeth[J].JEndod,2016,42(8):1167-1174.doi:10.1016/j.joen.2016.05.008.
[32]Asgary S,Eghbal MJ,Ghoddusi J,et al.One-year results of vital pulp therapy in permanent molars with irreversible pulpitis:an ongoing multicenter,randomized,non-inferiority clinical trial[J].Clin Oral Investig,2013,17(2):431-439.doi:10.1007/s00784-012-0712-6.
[33]Asgary S,Eghbal MJ,Ghoddusi J.Two-year results of vital pulp therapy in permanent molars with irreversible pulpitis:an ongoing multicenter randomized clinical trial[J].Clin Oral Investig,2014,18(2):635-641.doi:10.1007/s00784-013-1003-6.
[34]Asgary S,Eghbal MJ,Fazlyab M,et al.Five-year results of vital pulp therapy in permanent molars with irreversible pulpitis:a noninferiority multicenter randomized clinical trial[J].Clin Oral Investig,2015,19(2):335-341.doi:10.1007/s00784-014-1244-z.
[35]Asgary S,Hassanizadeh R,Torabzadeh H,et al.Treatment outcomes of 4 vital pulp therapies in mature molars[J].J Endod,2018,44(4):529-535.doi:10.1016/j.joen.2017.12.010.
[36]Cushley S,Duncan HF,Lappin MJ,et al.Pulpotomy for mature carious teeth with symptoms of irreversible pulpitis:a systematic review[J].J Dent,2019,88:103158.doi:10.1016/j.jdent.2019.06.005.
[37]Na TH,Khazali MA.Partial pulpotomy in mature permanent teeth with clinical signs indicative of irreversible pulpitis:a randomized clinical trial[J].J Endod,2017,43(9):1417-1421.doi:10.1016/j.joen.2017.03.033.
[38]Elmsmari F,Ruiz XF,MiróQ,et al.Outcome of partial pulpotomy in cariously exposed posterior permanent teeth:a systematic review and meta-analysis[J].J Endod,2019,45(11):1296-1306.e3.doi:10.1016/j.joen.2019.07.005.
[39]European Society of Endodontology (ESE) Developed by:,Duncan HF,Galler KM,et al.European society of endodontology position statement:management of deep caries and the exposed pulp[J].Int Endod J,2019,52(7):923-934.doi:10.1111/iej.13080.
[40]Linsuwanont P,Wimonsutthikul K,Pothimoke UA.Treatment outcomes of mineral trioxide aggregate pulpotomy in vital permanent teeth with carious pulp exposure:the retrospective study[J].J Endod,2017,43(2):225-230.doi:10.1016/j.joen.2016.10.027.
[41]Galani M,Tewari S,Sangwan P,et al.Comparative evaluation of postoperative pain and success rate after pulpotomy and root canal treatment in cariously exposed mature permanent molars:a randomized controlled trial[J].J Endod,2017,43(12):1953-1962.doi:10.1016/j.joen.2017.08.007.
[42]Asgary S,Nosrat A,Homayounfar N.Periapical healing after direct pulp capping with calcium-enriched mixture cement:a case report[J].Oper Dent,2012,37(6):571-575.doi:10.2341/11-417-S.
[43]Kunert GG,Kunert IR,Da Costa FL,et al.Permanent teeth pulpotomy survival analysis:retrospective follow-up[J].J Dent,2015,43(9):1125-1131.doi:10.1016/j.jdent.2015.06.010.
[44]Alqaderi H,Lee CT,Borzangy S,et al.Coronal pulpotomy for cariously exposed permanent posterior teeth with closed apices:a systematic review and meta-analysis[J].J Dent,2016,44:1-7.doi:10.1016/j.jdent.2015.12.005.
[45]Akhlaghi N,Khademi A.Outcomes of vital pulp therapy in permanent teeth with different medicaments based on review of the literature[J].Dent Res J (Isfahan),2015,12(5):406-417.doi:10.4103/1735-3327.166187.
[46]Petrou MA,Alhamoui FA,Welk A,et al.A randomized clinical trial on the use of medical Portland cement,MTA and Calcium hydroxide in indirect pulp treatment[J].Clin Oral Investig,2014,18(5):1383-1389.doi:10.1007/s00784-013-1107-z.
[47]Komabayashi T,Zhu Q,Eberhart R,et al.Current status of direct pulp-capping materials for permanent teeth[J].Dent Mater J,2016,35(1):1-12.doi:10.4012/dmj.2015-013.
[48]Suhag K,Duhan J,Tewari S,et al.Success of direct pulp capping using mineral trioxide aggregate and Calcium hydroxide in mature permanent molars with pulps exposed during carious tissue removal:1-year follow-up[J].J Endod,2019,45(7):840-847.doi:10.1016/j.joen.2019.02.025.
[49]Kang CM,Kim SH,Shin Y,et al.A randomized controlled trial of Pro Root MTA,Ortho MTA and Retro MTA for pulpotomy in primary molars[J].Oral Dis,2015,21(6):785-791.doi:10.1111/odi.12348.
[50]Omidi S,Bagheri M,Fazli M,et al.The effect of different pulpcapping materials on proliferation,migration and cytokine secretion of human dental pulp stem cells[J].Iran J Basic Med Sci,2020,23(6):768-775.doi:10.22038/ijbms.2020.41511.9814.
[51]Na TH,Abdulkhader SZ.Full pulpotomy with biodentine in symptomatic young permanent teeth with carious exposure[J].J Endod,2018,44(6):932-937.doi:10.1016/j.joen.2018.03.003.
[52]Rao Q,Kuang J,Mao C,et al.Comparison of i Root BP plus and Calcium hydroxide as pulpotomy materials in permanent incisors with complicated crown fractures:a retrospective study[J].J Endod,2020,46(3):352-357.doi:10.1016/j.joen.2019.12.010.
[53]Okamoto M,Takahashi Y,Komichi S,et al.Novel evaluation method of dentin repair by direct pulp capping using high-resolution micro-computed tomography[J].Clin Oral Investig,2018,22(8):2879-2887.doi:10.1007/s00784-018-2374-5.
[54]Matsuura T,Ziauddin SM,Kawata-Matsuura V,et al.Long-term clinical and radiographic evaluation of the effectiveness of direct pulp capping materials:a meta-analysis[J].Dent Mater J,2020:2020-2043.doi:10.4012/dmj.2020-043.
[55]Harms CS,Schäfer E,Dammaschke T.Clinical evaluation of direct pulp capping using a Calcium silicate cement-treatment outcomes over an average period of 2.3 years[J].Clin Oral Investig,2019,23(9):3491-3499.doi:10.1007/s00784-018-2767-5.
[56]Wolters WJ,Duncan HF,Tomson PL,et al.Minimally invasive endodontics:a new diagnostic system for assessing pulpitis and subsequent treatment needs[J].Int Endod J,2017,50(9):825-829.doi:10.1111/iej.12793.
[57]Ansari G,Safi AH,Taheri P,et al.Laser pulpotomy-an effective alternative to conventional techniques-a systematic review of literature and meta-analysis[J].Lasers Med Sci,2018,33(8):1621-1629.doi:10.1007/s10103-018-2588-4.
[58]周学东,黄定明,刘建国,等.牙髓损伤的活髓保存治疗[J].华西口腔医学杂志,2017,35(4):339-347.doi:10.7518/hxkq.2017.04.001.Zhou XD,Huang DM,Liu JG,et al.Vital pulp therapy of damaged dental pulp[J].West China J Stomatol,2017,35(4):339-347.doi:10.7518/hxkq.2017.04.001.
[59]Hanna SN,Perez AR,Prichard J.Vital pulp therapy an insight over the available literature and future expectations[J].Eur Endod J,2020,5(1):46-53.doi:10.14744/eej.2019.44154.