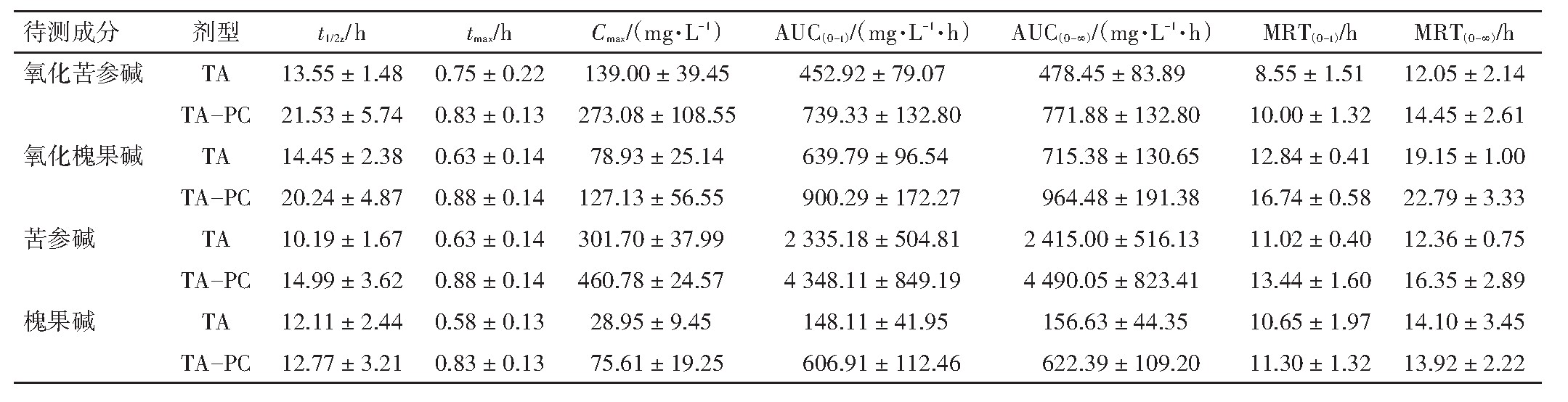
摘 要:目的 以氧化苦参碱、氧化槐果碱、苦参碱、槐果碱为指标成分,研究苦参总生物碱(TA)及苦参总生物碱磷脂复合物(TA-PC)在大鼠体内的药动学特征。方法 建立超高液相色谱-串联质谱(UPLC-MS/MS)同时定量测定大鼠血浆中4个生物碱的分析方法,以小檗碱为内标,乙酸乙酯液-液萃取法提取血浆样品,在ACQUITY UPLC®HSS T3 C18柱上梯度洗脱分离。乙腈-10 mmoL·L-1乙酸铵为流动相体系。在多反应离子监测(MRM)模式下使用电喷雾离子化电离源(ESI)进行正离子方式检测。以DAS 2.0软件处理数据。结果 TA给药后,氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的t1/2z分别为13.55、14.45、10.19、12.11 h,AUC0→∞分别为478.45、715.38、2 415.00、156.63 mg·L-1·h,MRT0→∞分别为12.05、19.15、12.36、14.10 h;TA-PC给药后,t1/2z分别为21.53、20.24、14.99、12.77 h,AUC0→∞分别为771.88、964.48、4 490.05、622.39 mg·L-1·h,MRT0→∞分别为14.45、22.79、16.35、13.92 h;TA-PC中氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的相对生物利用度分别为161.33%、134.82%、185.94%、397.36%。结论 所建立的方法灵敏、准确、高效,可用于大鼠体内4个苦参生物碱成分的药动学研究,制成TA-PC后能够显著提高TA大鼠体内生物利用度并延长体内作用时间。
关键词:苦参 生物碱 磷脂复合物 超高液相色谱-串联质谱 药动学
Study on Pharmacokinetics of Total Alkaloids of Sophora flavescens and Its Phospholipid Complex
YANG Zhixin TANG Haixia XING Xiwang LI Xia ZHANG Lifen LYU Shaowa
College of Pharmacy,Heilongjiang University of Chinese Medicine; Tianjin Kelun Pharmaceutical Research Co.,Ltd;
Abstract:Objective The pharmacokinetic characteristics of total alkaloid(TA) and total alkaloid phospholipid complex(TA-PC) of Sophora flavescens in rats were studied using oxymatrine(OMT), oxysophocarpine(OSC),matrine(MT) and sophocarpine(SC) as index components.Methods In this study, a method for simultaneous determination of four alkaloids in rats'(SD)plasma by ultra-high performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS)was established. Berberine was used as the internal standard(Ber). Plasma samples were extracted by ethyl acetate liquid-liquid extraction and separated by gradient elution on ACQUITYUPLC®HSST3 C18 column. An acetonitrile(A)-ammonium acetate(10 mmoL·L-1)(B)forms the mobile phase system. The positive ion mode detection was carried out using electrospray ionization source in multi-reactive ion monitoring mode.DAS2.0 software was used to process the obtained data.Results After administration of TA,the T1/2zof OMT,OSC,MT and SC were 13.55 h, 14.45 h, 10.19 h and 12.11 h, respectively; and the AUC0→∞values were 478.45,715.38,2 415.00 and 156.63 mg·L-1·h,respectively;MRT0→∞were 12.05 h,19.15 h,12.36 h and 14.10 h. After TA-PC administration,the T1/2zof 21.53 h,20.24 h,14.99 h and 12.77 h;AUC0→∞values were 771.88,964.48,4 490.05 and 622.39 mg·L-1·h;MRT0→∞were 14.45 h,22.79 h,16.35 h and 13.92 h,respectively. The relative bioavailability of OMT,OSC,MT and SC in TA-PC was 161.33%、134.82%、185.94%、397.36%,respectively.Conclusion The established method was effectively used to study the pharmacokinetics of four components of Sophora flavescens in rats. TA-PC can significantly improve the bioavailability of TA in rats.
Keyword:Sophora flavescens Ait; alkaloid; phospholipid complex; ultra-performance liquid chromatography-tandem mass spectrometry; pharmacokinetics;
苦参总生物碱(Total alkaloids from Sophora flavescens,TA)是豆科植物苦参(Sophora flavescens Ait.)不同部位提取、分离出来的一类特征性成分[1-2],具抗肿瘤[3-6]、抗心律失常[7]、抗病毒[8]、抗菌、抗炎[9]等多种药理作用。TA脂溶性小[10],其主要成分氧化苦参碱(Oxymatrine,OMT)、苦参碱(Matrine,MT)在大鼠体内的绝对生物利用度分别为9.31%、47.4%[11-12],槐果碱(Sophocarpine,SC)和氧化槐果碱(Oxidized sophorin,OSC)在体内消除快[13-14],提示如何延长TA在体内的作用时间且提高其生物利用度成为首要解决的问题。基于此,本课题组前期制备了TA的磷脂复合物(Phospholipid complex,PC),拟通过改善溶解性影响其体内吸收特性。结果表明,苦参总生物碱磷脂复合物水中溶解度下降,油水分配系数明显增加[15]。为进一步探讨其体内过程,本实验建立了同时测定大鼠体内4个苦参生物碱的超高液相色谱-串联质谱(UPLC-MS/MS)分析方法,探究苦参总生物碱磷脂复合物(Total alkaloid phospholipid complex of Sophora flavescens,TA-PC)在大鼠体内药动学行为并计算其生物利用度,为TA-PC的深入研究提供实验数据。
1 材料
1.1 仪器
CQUITYTM TQD超高效液相色谱仪串联三重四级杆质谱仪、色谱工作站ACQUITYTM UPLC系统(美国Waters公司);AL204电子天平(梅特勒-托利多仪器上海有限公司);WH-1微型涡旋混合器(上海沪西分析仪器厂有限公司);微量移液器(北京卓信伟业科技有限公司);Forma-80℃低温冰箱(美国Thermo公司);BF-2000氮吹仪(北京八方世纪科技有限公司);Milli-Q超纯水机(美国Millipore公司)。
1.2 药品与试剂
TA(本实验室自制,质量分数>80%);氧化苦参碱(OMT)、氧化槐果碱(OSC)、苦参碱(MT)、槐果碱(SC)(成都普瑞法科技开发有限公司,纯度均大于98%,批号分别为:PRF19022805、PRF7050922、PRF19041106、PRF7051921);小檗碱(成都德思特生物技术有限公司,纯度≥98%,批号:DST170103-009);甲醇、乙腈(美国Fisher公司,色谱纯,批号分别为:191024、191114);乙酸铵(上海阿拉丁生化科技股份有限公司,批号:F1901035);屈臣氏蒸馏水(中国屈臣氏集团,批号:20190319)。
1.3 动物
SD大鼠12只,SPF级,体质量(250±10)g,雌雄各半,黑龙江中医药大学药物安全性评价中心提供,动物许可证号:SYXK(黑)2019-007。
2 方法与结果
2.1 色谱及质谱条件
2.1.1 UPLC色谱条件
ACQUITY UPLC®HSS T3 C18色谱柱column(2.1 mm×100 mm,1.8μm);流动相为乙腈(A)-10 mmo L·L-1乙酸铵(B),梯度洗脱:0~3 min(30%A),3~3.2 min(60%~30%A),3.2~4.0 min(30%A);体积流量:0.2 m L·min-1;进样量:5μL;运行时间为4 min;柱温:35℃。
2.1.2 MS/MS质谱条件
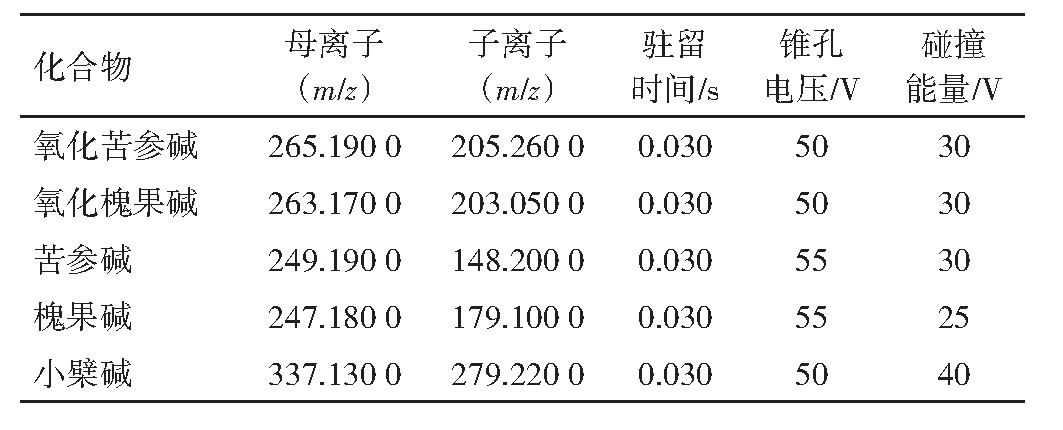
电喷雾离子源(ESI),毛细管电压3.5 k V,鞘气温度350℃,鞘气体积流量10 L·min-1,气体温度325℃,气体体积流量为8 L·min-1;氧化苦参碱、氧化槐果碱、苦参碱、槐果碱、小檗碱的锥孔电压分别为50、50、55、55、50 V;正离子方式检测;多反应离子监测(MRM)模式扫描,m/z 265→247、205(氧化苦参碱);m/z263→245、203(氧化槐果碱);m/z 249→148和249→176(苦参碱);m/z 247→136和247→179(槐果碱);m/z 337→293和337→279(小檗碱)。采用MasslynxTM4.1软件收集并处理数据,二级质谱图见图1,驻留时间、碰撞能量、离子质荷比见表1。
图1 氧化苦参碱(A)、氧化槐果碱(B)、苦参碱(C)、槐果碱(D)和内标(E)的质谱图和化学结构图
Figure 1 The mass spectrum and chemical structure of OMT(A),OSC(B),MT(C),SC(D)and IS(E)
表1 氧化苦参碱、氧化槐果碱、苦参碱、槐果碱和小檗碱的质谱参数
2.2 血浆样品处理
精密取100μL血浆样品及10μL内标(小檗碱)溶液(500 ng·m L-1)于2 m L离心管,涡旋混合3 min,再加1 m L二氯甲烷,涡旋混合3 min。以12 000 r·min-1离心10 min,取上清液800μL置于2 m L离心管中,40℃氮气流吹干;残余物用80μL甲醇溶解,涡旋混合3 min,以12 000 r·min-1离心10 min(离心半径4 cm),即得。按2.1.1项下色谱条件进样5μL,以UPLC-MS/MS分析,记录峰面积。
2.3 溶液的制备
2.3.1 TA灌胃供试液的制备
称取TA适量,精密称定为300.03 mg,溶于10 m L生理盐水中,涡旋3 min,超声助溶,制成浓度为30.00 mg·m L-1的TA溶液。
2.3.2 TA-PC灌胃供试液的制备
称取TA-PC适量,精密称定为420.00 mg(含TA 300.00 mg),以10 m L生理盐水涡旋3 min,超声分散,即得TA-PC灌胃供试液。
2.3.3 对照品溶液的制备
称取氧化苦参碱、氧化槐果碱、苦参碱、槐果碱对照品适量,分别精密称定为10.02、10.04、10.05、10.01 mg,分别置于10 m L量瓶中,甲醇溶解定容至刻度,得到浓度均为1.00 mg·m L-1的母液。分别精密量取母液适量于量瓶中,加甲醇稀释,定容至刻度,均配成浓度分别为5 000、2 000、1 000、500、100、10、1 ng·m L-1的溶液。密封,于4℃保存备用。
2.3.4 小檗碱(内标)溶液的制备
称取小檗碱对照品适量,精密称定10.00 mg置于10 m L量瓶中,甲醇溶解并稀释至刻度,摇匀,配成浓度为1.00 mg·m L-1的小檗碱母液。精密量取母液适量,甲醇稀释制成浓度500 ng·m L-1的标准溶液。密封,于4℃保存备用。
2.4 方法学考察
2.4.1 专属性考察
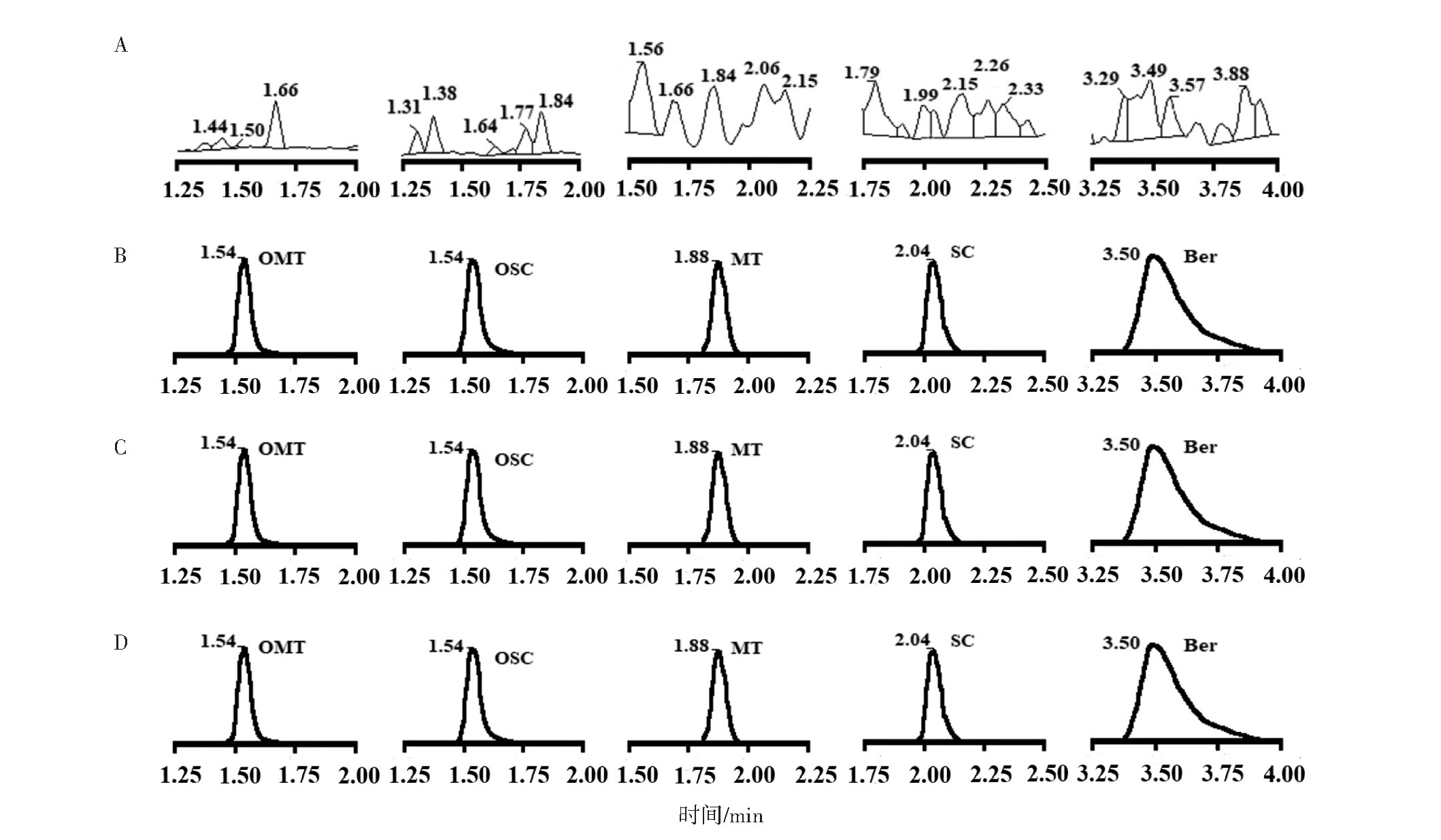
分别取空白血浆,空白血浆分别加氧化苦参碱、氧化槐果碱、苦参碱、槐果碱对照品溶液及内标小檗碱,大鼠灌胃TA及TA-PC供试液后的血浆样本(灌胃给药1 h的采血)。其中,空白血浆加氧化苦参碱、氧化槐果碱、苦参碱、槐果碱是在定量下限(lower limit of quantification,LLOQ)即浓度为1 ng·m L-1水平检测。按“2.2”项下方法处理后,按“2.1.1”项下色谱条件进样5μL,以UPLC-MS/MS分析,记录峰面积。结果色谱中氧化苦参碱、氧化槐果碱、苦参碱、槐果碱、小檗碱的保留时间分别为1.54、1.54、1.88、2.04、3.50 min。结果各组分峰形良好,完全分离,血浆杂质不干扰TA中4个成分与内标小檗碱的含量测定,表明本法具有较高的专属性。见图2。
图2 氧化苦参碱、氧化槐果碱、苦参碱、槐果碱和小檗碱的血浆样品色谱图
2.4.2 标准曲线与最低检测限
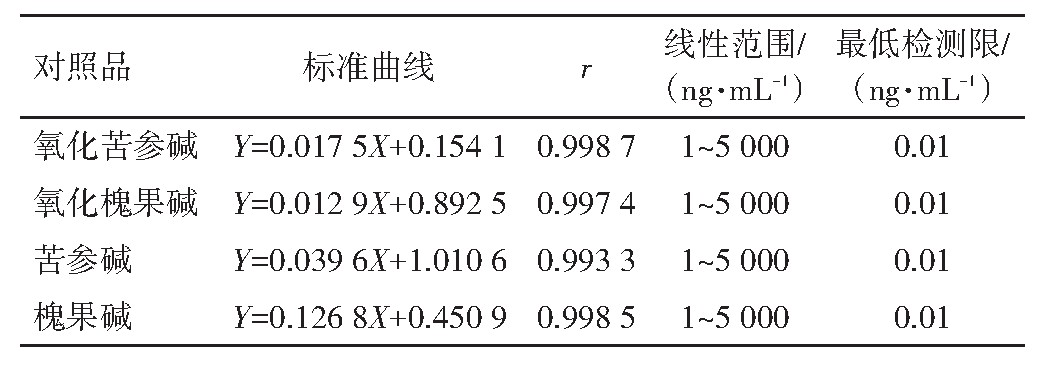
精密吸取“2.3.3”项下系列标准溶液,按照“2.1.1”项下色谱条件测定氧化苦参碱、氧化槐果碱、苦参碱、槐果碱、小檗碱的峰面积。以氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的浓度(X)为横坐标,氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的峰面积/小檗碱峰面积比值(Y)为纵坐标绘制标准曲线,采用加权(1/x2)最小二乘回归法,得出线性回归方程斜率(k)、截距(b)和相关系数(r)。标准曲线方程、线性范围见表2。在标准曲线最低浓度的基础上分别稀释2倍、5倍、10倍,按照“2.2”项下处理样品,测定最低检测限(lower limit of detection,LLOD),结果见表2。
2.4.3 精密度与准确度
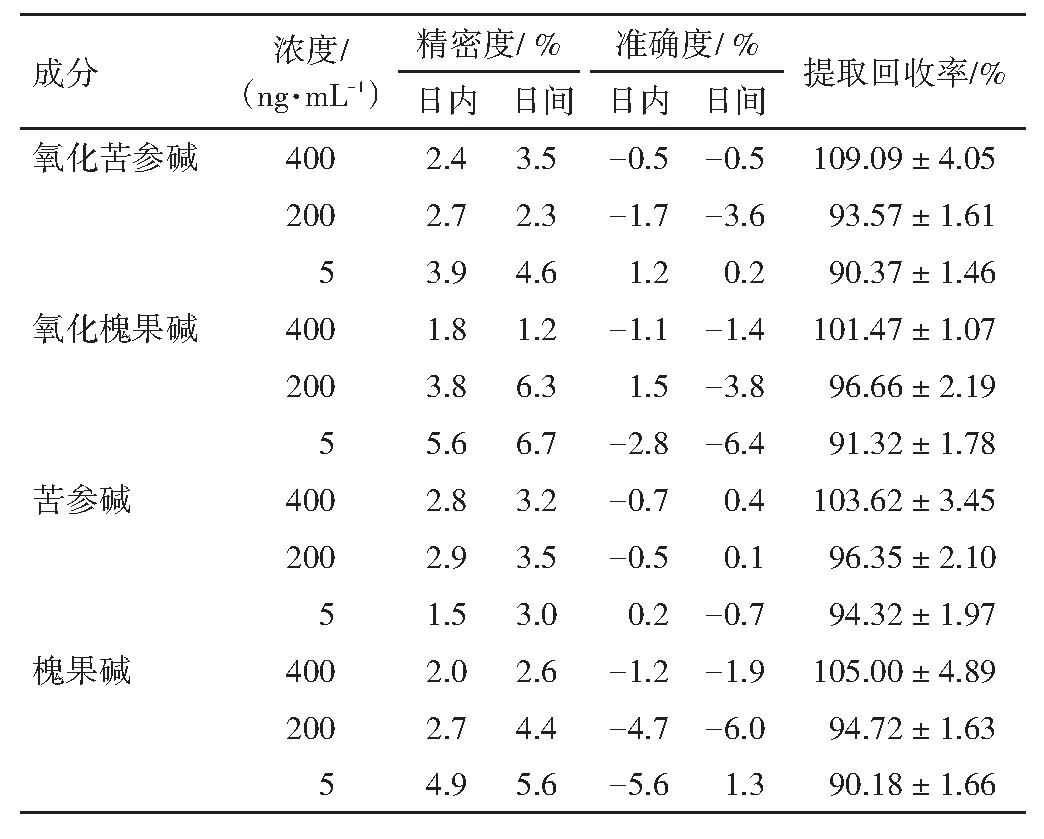
取空白血浆100μL,分别添加低、中、高3个质量浓度的氧化苦参碱、氧化槐果碱、苦参碱、槐果碱对照品溶液(5、200、400 ng·m L-1)作为质控样品;按照“2.2”项下方法操作。每个浓度水平测定6份样品,连续测定6 d。以相对标准偏差(RSD)表示精密度;以相对误差(RE)表示准确度。结果见表3。结果提示精密度与准确度符合实验要求。
表2 4个苦参生物碱的标准曲线与最低检测限
2.4.4 提取回收率
取空白血浆100μL于离心管中,分别添加低、中、高3个质量浓度的氧化苦参碱、氧化槐果碱、苦参碱、槐果碱对照品溶液(5、200、400 ng·m L-1)质控样品进行分析,计算含量,并与相应浓度的未经处理的对照品溶液比较,计算提取回收率。结果见表3。4个苦参生物碱成分的提取回收率均在90%以上,表明提取方法符合要求。
2.4.5 稳定性考察
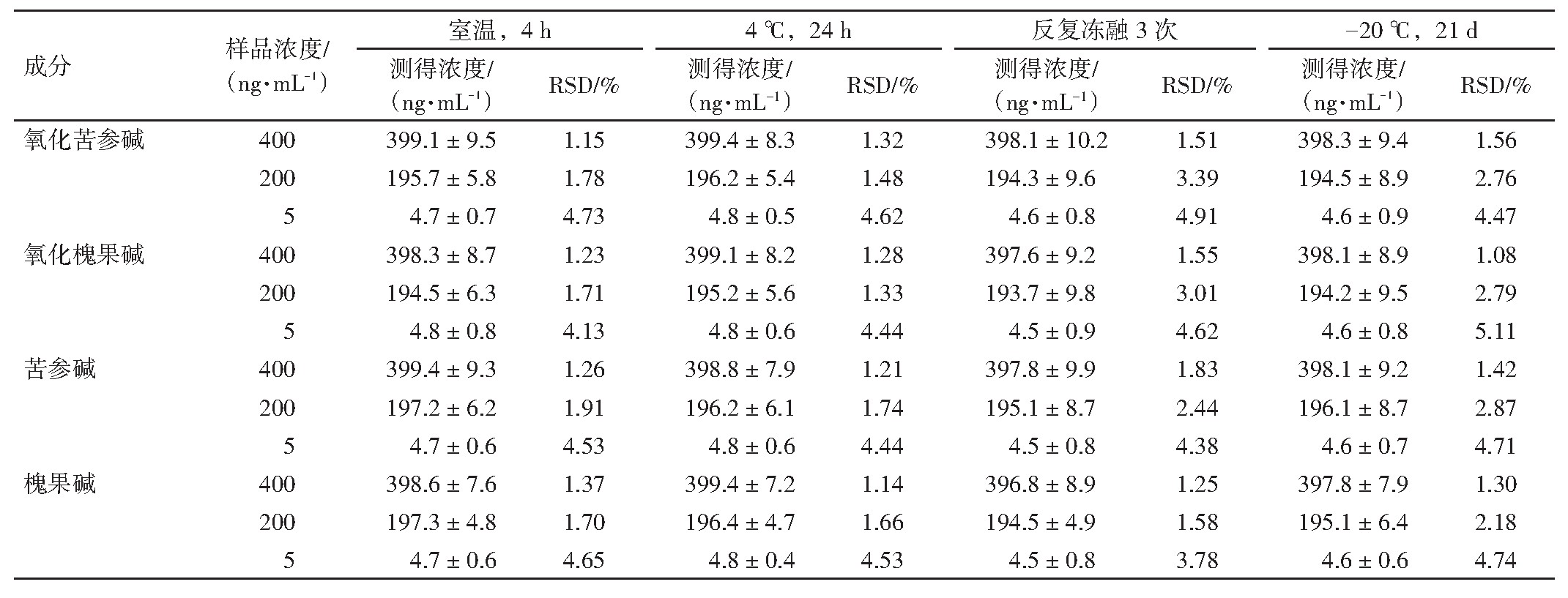
取质控样品(5、200、400 ng·m L-1)分别考察血浆样品在室温下放置4 h、血浆样品提取液在4℃自动进样器中放置24 h、反复冻融3次、血浆样品放置在-20℃冰箱21 d。按“2.1.1”项下进样分析,结果见表4。4个苦参生物碱成分在上述条件下均稳定,在分析测试过程中未产生明显的浓度变化,符合实验要求。
2.5 药代动力学研究
2.5.1 给药方案与血样采集
取健康SD大鼠12只,随机分成2组,给药前禁食12 h,自由饮水。分别口服灌胃给药TA和TA-PC供试液(给药剂量TA均为40 mg·kg-1),分别于给药后0.083、0.25、0.5、0.75、1、2、4、6、8、10、12、24、48、72 h眼底静脉丛取血(约0.3 m L);置于涂有肝素的1.5 m L离心管中,以5 000 r·min-1离心10 min,取大鼠血浆100μL。
表3 4个苦参生物碱的精密度、准确度及提取回收率结果
表4 氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的稳定性试验(±s,n=6)
2.5.2 药代动力参数
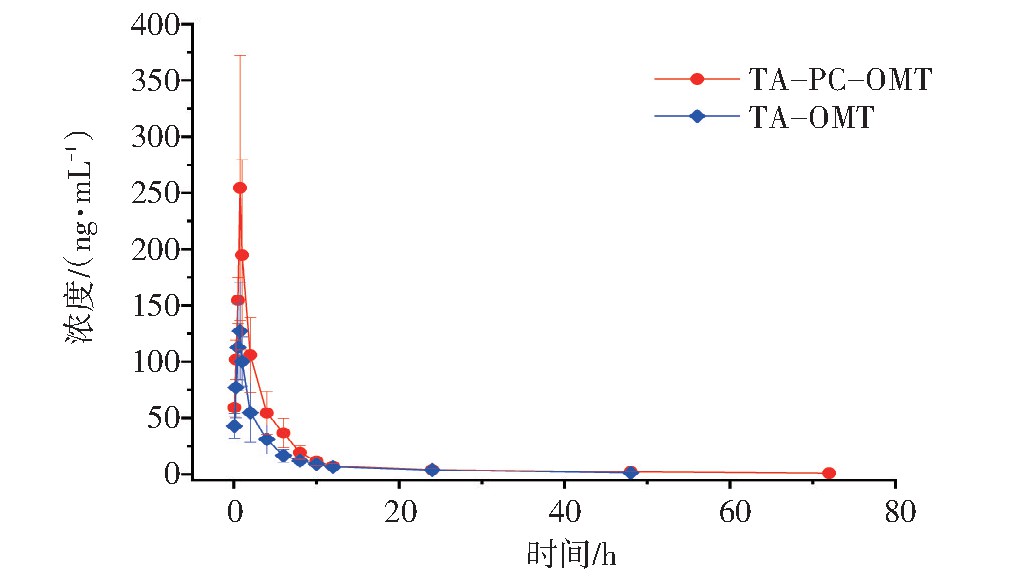
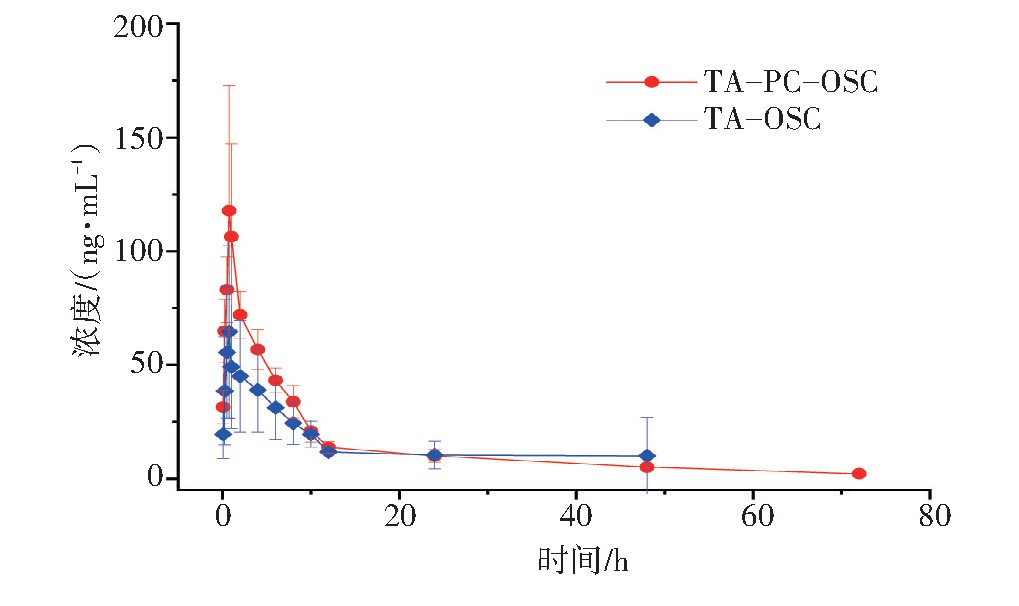
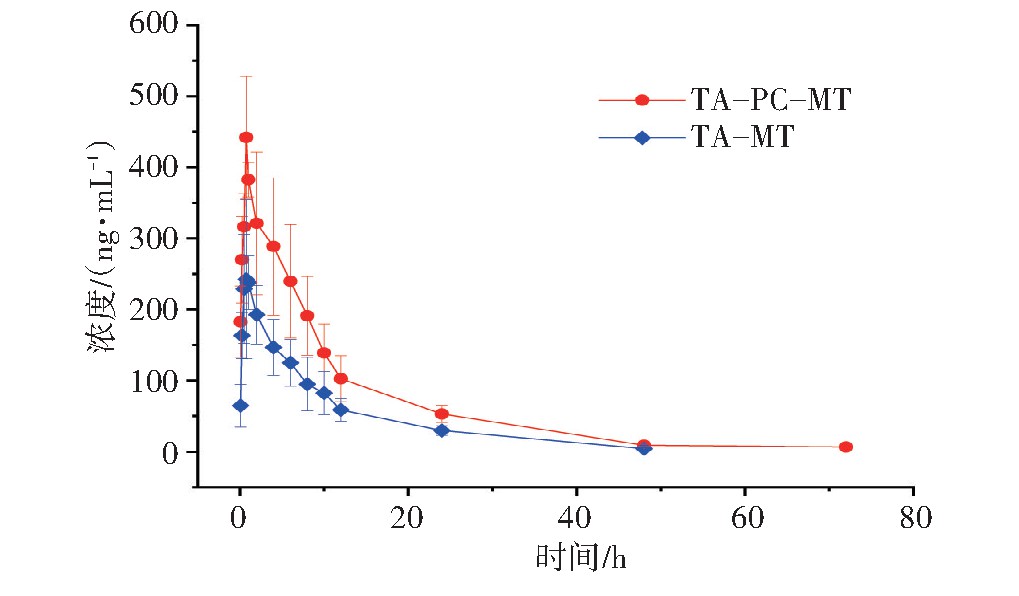
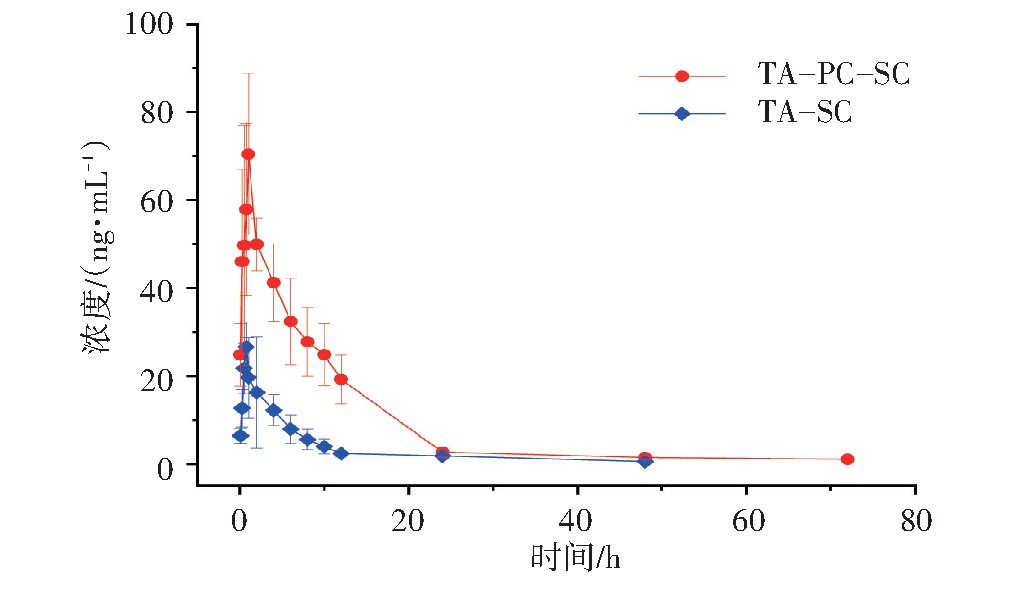
取不同时间点血浆样品,按照“2.2”项下处理,进样分析并记录氧化苦参碱、氧化槐果碱、苦参碱、槐果碱、小檗碱的峰面积,计算各组分的血药浓度,分别绘制TA和TA-PC给药后氧化苦参碱、氧化槐果碱、苦参碱、槐果碱平均血药浓度-时间(Concentration-time,C-t)曲线,见图3~图6。以DAS 2.0软件拟合C-t曲线和药动学参数,将TA和TA-PC中4个苦参生物碱成分的平均血药浓度分别按一室、二室、三室模型进行模拟,获得决定系数(R2)最大和AIC最小作为判断标准,确定TA和TA-PC中各成分在大鼠体内的药-时过程均符合二室开放模型(权重1/C2),药物动力学参数见表5。根据相对生物利用度(F)=(AUC0→∞磷脂复合物)/(AUC0→∞原药)×100%,计算得到氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的F值分别是161.33%、134.82%、185.94%、397.36%。提示TA-PC能够显著提高TA大鼠体内生物利用度。
图3 大鼠口服灌胃给药苦参总生物碱(TA)和TA-PC后氧化苦参碱(OMT)的C-t曲线
图4 大鼠口服灌胃给药苦参总生物碱(TA)和TA-PC后氧化槐果碱(OSC)的C-t曲线
图5 大鼠口服灌胃给药苦参总生物碱(TA)和TA-PC后苦参碱(MT)的C-t曲线
图6 大鼠口服灌胃给药苦参总生物碱(TA)和TA-PC后槐果碱(SC)的C-t曲线
3 讨论
本研究建立了UPLC-MS/MS同时测定苦参总生物碱(TA)中4个生物碱的分析方法,发现色谱条件对各成分的峰型、保留时间及响应值有较大影响。分别对乙腈-0.1%甲酸水(含10 mmol·L-1醋酸铵)、乙腈-水(含0.1%甲酸)、乙腈-醋酸铵(10 mmol·L-1)、0.1%甲酸乙腈-0.1%甲酸水(含10 mmol·L-1醋酸铵)等4种流动相体系进行比较,结果乙腈-醋酸铵(10 mmol·L-1)系统色谱峰峰型较好。
大鼠口服灌胃TA及TA-PC后,氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的血药浓度均呈现先增加后降低趋势。与TA比较,TA-PC灌胃后氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的相对生物利用度分别为161.33%、134.82%、185.94%、397.36%,提示磷脂复合物提高了指标成分体内的吸收总量,相对生物利用度显著提高。大鼠口服灌胃TA后,氧化苦参碱、氧化槐果碱、苦参碱、槐果碱的t1/2z分别为13.55、14.45、10.19、12.11 h;MRT(0-∞)分别为12.05、19.15、12.36、14.10 h;口服灌胃TA-PC后,相应成分的t1/2z分别为21.53 h、20.24 h、14.99 h、12.77 h,MRT(0-∞)分别为14.45 h、22.79 h、16.35 h、13.92 h。结果提示制成磷脂复合物后,药物成分总体从体内的消除速度均明显减慢,体内的停留时间延长。值得注意的是,槐果碱尽管在制成磷脂复合物后亦能延长体内存留时间(由12.11 h延长至12.77 h),但并不明显。有研究[16-18]表明,氧化槐果碱为氧化型的生物碱,槐果碱为还原型生物碱,二者在体内外可能存在相互转化现象,推测槐果碱延长体内作用时间不明显可能是在体内一定条件下发生了某种转化。该转化的条件、机制有待进一步研究。
表5 苦参总生物碱(TA)溶液和TA-PC中氧化苦参碱、氧化槐果碱、苦参碱和槐果碱的药动学参数(Weight=1/C2,±s,n=6)
参考文献
[1] HE X,FANG J,HUANG L,et al. Sophora flavescens Ait.:Traditional usage, phytochemistry and pharmacology of an important traditional Chinese medicine[J]. Ethnopharmacol,2015,22:10-29.
[2]黄晓斌,汪欢,陈志鹏,等. Box-Behnken响应面法优化苦参黄酮超声提取工艺[J].中药材,2019,42(10):2352-2356.
[3] ZHANG X,HOU G,LIU A,et al. Matrine inhibits the development and progression of ovarian cancer by repressing cancer associated phosphorylation signaling pathways[J]. Cell Death Dis, 2019, 10(10):770.
[4]陈晓红,王海琳,吴慧芳,等.苦参碱对宫颈癌SiHa细胞中自噬基因Beclin1和LC3Ⅱ表达的影响[J].中国临床药理学杂,2020,36(13):1845-1849.
[5]刘平,陈晓杰.苦参碱上调LncRNA BDNF-AS抑制宫颈鳞癌细胞增殖的机制研究[J].中草药,2020,51(6):1593-1599.
[6]鲍娇琳,陆金健,陈修平,等.苦参碱与氧化苦参碱抗肿瘤作用及其机制的研究进展[J].中药新药与临床药理,2012,23(3):369-373.
[7] ZHOU Y H,WU Y,DENG L,et al. The alkaloid matrine of the root of Sophora flavescens prevents arrhythmogenic effect of ouabain[J]. Phytomedicine,2014,21:931-935.
[8]丁志远,陈新梅,段章好,等.氧化苦参碱磷脂复合物的制备、表征和体外抗乙肝病毒研究[J].中药新药与临床药理,2019,30(8):974-978.
[9]张丽华,陈燕,彭雨舒,等.中药苦参水提取物抑制Th17细胞分化的研究[J].中药新药与临床药理,2020,31(3):251-256.
[10]张晓雯,李凌宇,尚海,等.苦参碱及其类似物的结构修饰研究进展[J].中草药,2019,50(23):5892-5900.
[11]刘苏,秦晶,陆伟根,等.氧化苦参碱在大鼠体内药代动力学特征[J].中成药,2011,33(6):962-965.
[12]刘瑞林,辛顺妹.苦参碱的利胆作用与药代动力学的关系[J].中成药,1996,18(8):25-26.
[13]冯春玲,佘柽柏,刘冬敏,等.槐果碱和槐定碱的药动学研究[J].中国新药杂志,2009,18(8):759-762.
[14]张明发,沈雅琴.槐果碱和氧化槐果碱的药动学研究进展[J].抗感染药学,2020,17(4):463-467.
[15]杨志欣,王海威,张文君,等.星点设计-效应面优化苦参总生物碱组分磷脂复合物研究[J].中药材,2018,41(3):660-664.
[16]冷晓红,郭鸿雁,陈海燕.苦豆子提取过程中氧化苦参碱与苦参碱、氧化槐果碱与槐果碱的相互转化[J].中国现代应用药学,2015,32(6):688-691.
[17]宋小妹,考玉萍.洁身洗剂中苦参化学成分转化研究[J].西北药学杂志,2000,15(6):257-259.
[18]王明雷,周秋丽,王本祥.氧化苦参碱肠内菌代谢及吸收入血活性成分的研究[J].中国中药杂志,2001,26(4):56-58.